Đề kiểm tra học kỳ I lớp 10 - Môn: Hóa (chương trình: chuẩn)
Câu 1. Trong tự nhiên đồng có hai đồng vị 20Ne và 22Ne . Nguyên tử khối trung bình là 20,18. Phần trăm của đồng vị 20Ne và 22Ne là:
A.75% và 25% B.86% và 14% C.77% và 23% D.91% và 9%
Câu 2. Trong phân tử HF số cặp electron dùng chung là:
A.3 B.2 C.1 D.4
Câu 3. Cấu hình electron nào sau đây không đúng :
A.1s22s22p3 B.1s22s22p53s2 C.1s22s22p6 D.1s22s22p63s1
Câu 4. Một nguyên tố ở chu kỳ 3 nhóm VA , vậy cấu hình electron của nguyên tử nguyên tố này là:
A.1s22s22p63s23p4 B.1s22s22p63s23p3 C.1s22s22p63s33p2 D.1s22s22p63s23p5
Câu 5. Một nguyên tố tạo hợp chất khí với hidro có công thức RH4 . Nguyên tố này chiếm 46,7% về khối lượng trong oxit cao nhất. Nguyên tố này là:
A.N (M=14) B.S (M=32) C.P (M=31) D.Si(M=28)
Câu 6. Liên kết ion là liên kết được hình thành bởi:
A.Một phi kim và một phi kim B.Sự cho-nhận electron giữa các nguyên tử
C.Một kim lọai và một kim loại D.Các cặp electron ghép đôi
Câu 7. Liên kết cộng hoá trị:
A.Là liên kết được tạo nên bởi lực hút tĩnh điện giữa các ion trái dấu
B.Là liên kết được tạo nên giữa hai nguyên tử bằng một hoặc nhiều cặp electron dùng chung
C.Là liên kết được tạo nên giữa các nguyên tử kim loại và phi kim
D.Là liên kết được tạo nên giữa các nguyên tử bằng một hoặc nhiều cặp electron dùng chung
Câu 8. Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kỳ có tổng số proton trong hai hạt nhân là
27 . X và Y thuộc chu kỳ và nhóm:
A.CK2,IIIA và IVA B.CK2,IAvà IIIA C.CK3, IIIA và IVA D.CK3,IA và IIA
Câu 9. Nguyên tố có Z = 12 thuộc loại nguyên tố:
A.p B.s C.f D.d
Câu 10. Điện tích hạt nhân của nguyên tố có kí hiệu là:
A.12 B.12+ C.24 D.24+
Câu 11. Trong các phân lớp sau, phân lớp nào chưa bão hòa:
A.2s2 B.4f14 C.3p6 D.3d8
Câu 12. Ion X2+ có cấu hình electron lớp ngoài cùng 2p6. Vị trí của X là:
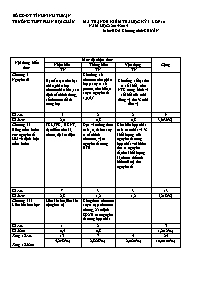
SỞ GD-ĐT TỈNH NINH THUẬN TRƯỜNG THPT PHAN BỘI CHÂU MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I LỚP 10 NĂM HỌC: 2014-2015 Môn: HÓA Chương trình:CHUẨN Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng TN TN TN Chương I Nguyên tử Hạt cấu tạo nên hạt nhân, phân lớp electron bão hòa,xác định cấu hình đúng, số electron tối đa trong lớp Cho tổng số electron trên phân lớp p suy ra số proton, cho biết z suy ra nguyên tố s,p,d,f Cho tổng số hạt tìm ra số khối, cho NTK trung bình và số khối của mỗi đồng vị tìm % mỗi đồn vị Số câu 5 2 2 9 Số điểm 2,0 0,8 0,8 3,6(36%) Chương II Bảng tuần hoàn các nguyên tố HH và định luật tuần hoàn TKL,TPK, BKNT, đặc điểm chu kì, nhóm, độ âm điện Dựa vào công thức oxit , z, đt ion suy ra cấu hình electron, vị trí nguyên tố trong BTH Cho biết hợp chất oxit cao nhất và % khối lượng của nguyên tố trong hợp chất với hidro tìm ra nguyên tố,cho khối lượng kl,nhóm thể tích hidro(đktc) tìm nguyên tố Số câu 7 3 3 13 Số điểm 2,8 1,2 1,2 5,2(52%) Chương III Liên kết hóa học Liên kết ion,liên kết cộng hoá trị Công thức electron suy ra cặp electron chung, Xác định SOXH các nguyên tố trong hợp chất Số câu 1 2 3 Số điểm 0,4 0,8 1,2(12%) Tổng số câu Tổng số điểm 13 7 5 25 5,2(52%) 2,8(28%) 2,0(20%) 10,0(100%) Sở GD-ĐT Ninh Thuận KIỂM TRA HỌC KÌ I -Năm học 2014-2015 Tr ường THPT Phan Bội Châu Môn: Hoá - Chương trình - Chuẩn Thời gian: 45 phút Họ tên học sinh: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .SBD: . . . . . . . . .Lớp: 10A . . . Câu 1. Trong tự nhiên đồng có hai đồng vị 20Ne và 22Ne . Nguyên tử khối trung bình là 20,18. Phần trăm của đồng vị 20Ne và 22Ne là: A.75% và 25% B.86% và 14% C.77% và 23% D.91% và 9% Câu 2. Trong phân tử HF số cặp electron dùng chung là: A.3 B.2 C.1 D.4 Câu 3. Cấu hình electron nào sau đây không đúng : A.1s22s22p3 B.1s22s22p53s2 C.1s22s22p6 D.1s22s22p63s1 Câu 4. Một nguyên tố ở chu kỳ 3 nhóm VA , vậy cấu hình electron của nguyên tử nguyên tố này là: A.1s22s22p63s23p4 B.1s22s22p63s23p3 C.1s22s22p63s33p2 D.1s22s22p63s23p5 Câu 5. Một nguyên tố tạo hợp chất khí với hidro có công thức RH4 . Nguyên tố này chiếm 46,7% về khối lượng trong oxit cao nhất. Nguyên tố này là: A.N (M=14) B.S (M=32) C.P (M=31) D.Si(M=28) Câu 6. Liên kết ion là liên kết được hình thành bởi: A.Một phi kim và một phi kim B.Sự cho-nhận electron giữa các nguyên tử C.Một kim lọai và một kim loại D.Các cặp electron ghép đôi Câu 7. Liên kết cộng hoá trị: A.Là liên kết được tạo nên bởi lực hút tĩnh điện giữa các ion trái dấu B.Là liên kết được tạo nên giữa hai nguyên tử bằng một hoặc nhiều cặp electron dùng chung C.Là liên kết được tạo nên giữa các nguyên tử kim loại và phi kim D.Là liên kết được tạo nên giữa các nguyên tử bằng một hoặc nhiều cặp electron dùng chung Câu 8. Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kỳ có tổng số proton trong hai hạt nhân là 27 . X và Y thuộc chu kỳ và nhóm: A.CK2,IIIA và IVA B.CK2,IAvà IIIA C.CK3, IIIA và IVA D.CK3,IA và IIA Câu 9. Nguyên tố có Z = 12 thuộc loại nguyên tố: A.p B.s C.f D.d Câu 10. Điện tích hạt nhân của nguyên tố có kí hiệu là: A.12 B.12+ C.24 D.24+ Câu 11. Trong các phân lớp sau, phân lớp nào chưa bão hòa: A.2s2 B.4f14 C.3p6 D.3d8 Câu 12. Ion X2+ có cấu hình electron lớp ngoài cùng 2p6. Vị trí của X là: A.CK3,VIA B.CK3,IIA C.CK2,VIA D.CK2,VIIIA Câu 13. Đáp án sai trong nguyên tử số đơn vị điện tích hạt nhân: A.Bằng số notron B.Bằng số thứ tự của nguyên tố trong bảng hệ thống tuần hoàn C.Bằng số proton D.Bằng số electron Câu 14. Tổng số electron,pronton,nơtron trong nguyên tử là 10.Biết Số khối của nguyên tử là: A.7 B.8 C.9 D.6 Câu 15. Xác định cộng hoá trị của các nguyên tố trong hợp chất CH4 A.C có cộng hoá trị 4, H cộng hoá trị 1 B.C có cộng hoá trị 2, H cộng hoá trị 2 C.C có cộng hoá trị 4, H cộng hoá trị 2 D.C có cộng hoá trị 3, H cộng hoá trị 1 Câu 16. Trong hợp chất ion hoá trị của nguyên tố: A.Bằng số liên kết của nguyên tử nguyên tố đó trong liên kết ion B.Bằng số liên kết của nguyên tử nguyên tố đó trong phân tử C.Bằng hoá trị của nguyên tố đó D.Bằng điện tích của ion đó và được gọi là điện hoá trị của nguyên tố đó Câu 17. Khi cho 3,425g một kim loại nhóm IIA tác dụng với nước tạo ra 0,560 lít khí hidro(ở đktc). Kim loại đó là: A.Ba (M=137) B.Ca (M=40) C.Be (M=9) D.Mg (M =24) Câu 18. Trong một nhóm A từ trên xuống dưới điều khẳng định nào sau đây là đúng: A.Khả năng nhận electron của nguyên tử phi kim tăng dần B.ĐÂĐ tăng dần C.Tính phi kim giảm dần D.Tính kim loại giảm dần Câu 19. Trong ion , số oxi hóa của lưu huỳnh là: A.+4 B.+7 C.+5 D.+6 Câu 20. Các nguyên tố trong cùng một nhóm A có đặc điểm nào chung sau đây: A.Số proton B.Số lớp electron C.Số electron lớp ngoài cùng D.Số electron Câu 21. Nguyên tố X có công thức oxit cao nhất là XO2 . X thuộc nhóm: A.IVA B.VIIIA C.VIA D.IIA Câu 22. Người tìm ra proton là: A.TÔM-XƠN B.BO C.RƠ-ĐƠ-PHO D.CHÁT-UÝCH Câu 23. Nguyên tử của nguyên tố nào trong các nguyên tử sau luôn nhường 2 electron trong các phản ứng hóa học: A.Al (Z=13) B.Na (Z=11) C.Si(Z=14) D.Mg (Z=12) Câu 24. Tính hiệu âm điện và cho biết loại liên kết của NaF (biết ) A.3,05, liên kết cộng hoá trị có cực B.3,05, liên kết cộng hoá trị không cực C.3,05, liên kết ion D.4,91, liên kết ion Câu 25. Số oxi hoá trong một phân tử : A.Tổng số số oxi hoá của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng không B.Số oxi hoá của nguyên tố bằng không C.Tổng số số oxi hoá của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích của ion đó D.Số oxi hoá của nguyên tố bằng điện tích của ion đó Sở GD-ĐT Ninh Thuận KIỂM TRA HỌC KÌ I -Năm học 2014-2015 Tr ường THPT Phan Bội Châu Môn: Hoá - Chương trình - Chuẩn Thời gian: 45 phút Họ tên học sinh: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .SBD: . . . . . . . . .Lớp: 10A . . . ĐÁP ÁN VÀ BIỂU ĐIỂM ĐÁP ÁN BIỂU ĐIỂM 1D 2C 3B 4B 5D 6.B 7B 8C 9B 10B Mỗi câu 0,4 điểm 11D 12B 13A 14A 15A 16D 17A 18C 19D 20C 21A 22C 23D 24C 25A
Tài liệu đính kèm:
 de_kiem_tra_hoc_ky_i_lop_10_mon_hoa_chuong_trinh_chuan.doc
de_kiem_tra_hoc_ky_i_lop_10_mon_hoa_chuong_trinh_chuan.doc





