Kiểm tra 1 tiết số 4 - Môn: Hoá học 10 (Cơ bản)
Câu 1:Chất nào không dùng để điều chế khí O2 trong phòng thí nghiệm?
A.H2O2. B.KMnO4. C.Na2CO3. D.KClO3.
Câu 2:Phản ứng chứng tỏ ozon có tính oxi hoá mạnh hơn oxi là
A.2Mg + O2 →2MgO. B.2Ag + O3 →Ag2O + O2.
C.3C + 2O3 →3CO2. D.C2H5OH + 3O2 →2CO2 + 3H2O.
Câu 3:Chọn phát biểu sai về oxi và ozon.
A.Khí oxi không màu. B.Khí ozon có màu xanh nhạt.
C.Khí oxi có mùi đặc trưng. D.Khí ozon tan nhiều trong nước nhiều hơn khí oxi.
Câu 4:Có hỗn hợp khí O2 và O3.Sau một thời gian,O3 bị phân hủy hết(2O3 → 3O2) ,ta được một chất duy nhất
có thể tích tăng thêm 5%.Phần trăm thể tích của O3 trong hỗn hợp đầu là
A.4%. B.6%. C.8%. D.10%.
Câu 5:Vị trí của nguyên tố lưu huỳnh trong bảng hệ thống tuần hoàn là
A.Chu kỳ 2,nhóm VIA. B. Chu kỳ 3,nhóm IVA. C. Chu kỳ 3,nhóm VIA. D. Chu kỳ 4,nhóm VIA.
Câu 6:Phản ứng hóa học nào sai?
A.H2 + S H2S. B. Hg + S HgS.
C.S + F2 SF6. D.2Fe + 3S Fe2S3.
Câu 7:Cho các phản phản ứng hóa học sau:
(1) H2 + S → H2S . (2) S + O2 →SO2.
(3) Ca + S → CaS. (4) S + H2SO4 → SO2 + H2O.
Số phản ứng mà lưu huỳnh đơn chất thể hiện tính khử là
A.1. B.2. C.3. D.4.
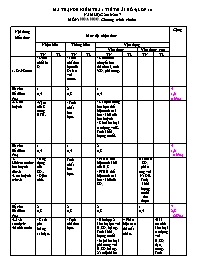
MA TRẬN ĐỀ KIỂM TRA 1 TI ẾT (B ÀI S Ố 4) LỚP 10 NĂM HỌC 2016-2017 MÔN: HOÙA HOÏC. Chương trình chuẩn Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL 1. Oxi-Ozon - Điều chế khí O2 - Tính chất hoá học của Oxi so với ozon. - Cho ozon chuyển hóa thành oxi, tính %O3 phản ứng. Số câu Số điểm (%) 1 0,4 2 0,8 1 0,4 4 1,6 (16%) 2. Lưu huỳnh -Vị trí của S trong BTH. - Tính chất hóa học. - Các phản ứng hoá học thể hiện tính oxi hóa - khử của lưu huỳnh - Cho kim loại tác dụng với S. Tính khối lượng muối. Số câu Số điểm (%) 1 0,4 1 0,4 2 0,8 4 1,6 (16%) 3. Hidrosunfua-lưu huynh dioxit -Lưu huỳnh trioxit - Ứng dụng của SO2. - Điều chế. Tính chất hóa học. - PTHH thể hiện tính khử của H2S - PTHH thể hiện tính oxi hóa- khử của SO2 Bài toán SO2 phản ứng với NaOH. Tính khối lượng muối thu được Số câu Số điểm (%) 2 0,8 2 0,8 2 0,8 1 0,4 7 2,8 (28%) 4.Axit sunfuric -Muối sunfat - Cách pha loãng axit đặc. - Tính chất hóa học. - Hỗn hợp 2 kim loại pư với H2SO4 loãng. Tính khối lượng muối - Một kim loại phản ứng với H2SO4 loãng. Xác định kim loại * Phân biệt các dd mất nhãn. -Bài toán hh kim loại tác dụng với H2SO4 đặc, nóng. Tính %m Số câu Số điểm (%) 1 0,4 2 0,8 2 0,8 1 1,0 1 1,0 7 4,0 (40%) Tổng số câu 5 7 7 1 1 1 22 5 7 8 2 Tổng số điểm (%) 2,0 (20%) 2,8 (28%) 3,8 (38%) 1,4 (14%) 10 (100%) Họ và tên: . Lớp . Sở GD & ĐT NINH THUẬN KIỂM TRA 1 TIẾT SỐ 4 NĂM HỌC 2016-2017 Trường THPT Trường Chinh Môn: Hoá Học 10 cơ bản Thời gian:45 phút (Cho Na:23;O:16;H: Mg:24; Zn:65; Ba:137;Mn:55; Fe:56; Al:27;S:32) I.Trắc nghiệm(8đ) Câu 1:Chất nào không dùng để điều chế khí O2 trong phòng thí nghiệm? A.H2O2. B.KMnO4. C.Na2CO3. D.KClO3. Câu 2:Phản ứng chứng tỏ ozon có tính oxi hoá mạnh hơn oxi là A.2Mg + O2 →2MgO. B.2Ag + O3 →Ag2O + O2. C.3C + 2O3 →3CO2. D.C2H5OH + 3O2 →2CO2 + 3H2O. Câu 3:Chọn phát biểu sai về oxi và ozon. A.Khí oxi không màu. B.Khí ozon có màu xanh nhạt. C.Khí oxi có mùi đặc trưng. D.Khí ozon tan nhiều trong nước nhiều hơn khí oxi. Câu 4:Có hỗn hợp khí O2 và O3.Sau một thời gian,O3 bị phân hủy hết(2O3 → 3O2) ,ta được một chất duy nhất có thể tích tăng thêm 5%.Phần trăm thể tích của O3 trong hỗn hợp đầu là A.4%. B.6%. C.8%. D.10%. Câu 5:Vị trí của nguyên tố lưu huỳnh trong bảng hệ thống tuần hoàn là A.Chu kỳ 2,nhóm VIA. B. Chu kỳ 3,nhóm IVA. C. Chu kỳ 3,nhóm VIA. D. Chu kỳ 4,nhóm VIA. Câu 6:Phản ứng hóa học nào sai? A.H2 + S H2S. B. Hg + S HgS. C.S + F2 SF6. D.2Fe + 3S Fe2S3. Câu 7:Cho các phản phản ứng hóa học sau: (1) H2 + S → H2S . (2) S + O2 →SO2. (3) Ca + S → CaS. (4) S + H2SO4 → SO2 + H2O. Số phản ứng mà lưu huỳnh đơn chất thể hiện tính khử là A.1. B.2. C.3. D.4. Câu 8:Nung 5,4 gam bột kim loại Al và 10,56 gam bột S.Sau khi phản ứng xảy ra hoàn toàn thì thu được bao nhiêu gam muối? A.15gam. B.1,65gam . C.15,96gam. D.11,8gam. Câu 9:Chất nào được dùng để sản xuất khí SO2 trong công nghiệp? A.H2S B.FeS2 C.Na2SO3 D.H2SO4 Câu 10:Ứng dụng nào không phải của SO2? A.Làm chất tẩy trắng. B.Chống nấm mốc. C.Sản xuất H2SO4. D.Lưu hóa cao su. Câu 11:Phương trình hóa học nào sai? A.SO2 + NaOH → NaHSO3 B. SO2 + 2NaOH → Na2SO3 + H2O C. SO2 + H2O ↔ H2SO4 D. 2SO2 + O2 2SO3 Câu 12: Phương trình hóa học nào thể hiện tính oxi hóa của SO2? A.SO2 + 2H2S → 3 S + 2H2O B.SO2 + Br2 + H2O → 2HBr + H2SO4 C.SO2 + 2NaOH → Na2SO3 + H2O D.SO2 + Fe2(SO4)3 +2H2O → 2H2SO4 + 2FeSO4 Câu 13:Phương trình hóa học nào thể hiện tính khử của H2S? A.H2S + 2NaOH→ Na2S + 2H2O B. H2S + NaOH→ NaHS + H2O C.H2S + O2 → SO2 + H2O D.H2S + CuSO4 → CuS + H2SO4 Câu 14: Phương trình hóa học nào thể hiện tính oxi hóa của SO2? A.SO2 + 2H2S → 3 S + 2H2O B.SO2 + Br2 + H2O → 2HBr + H2SO4 C.SO2 + 2NaOH → Na2SO3 + H2O D.SO2 + Fe2(SO4)3 +2H2O → 2H2SO4 + 2FeSO4 Câu 15:Cho 2,24 lít khí SO2 vào 200ml dung dịch NaOH 0,7M,sau khi phản ứng xảy ra hoàn toàn thì khối lượng muối thu được là A.11,28 gam B.12,60 gam C.10,40 gam D.14,56 gam Câu 16:Chọn cách pha loãng axit H2SO4 đặc an toàn nhất A.Cho thật nhanh axit vào nước B. Cho thật nhanh nước vào axit C.Cho từ từ nước vào axit D.Cho từ từ axit vào nước Câu 17:Cho các phản ứng hóa học sau: (1) H2SO4 + 2NaOH → Na2SO4 +H2O (2) H2SO4 + 2Na2O → Na2SO4 +H2O (3) H2SO4 + CaCO3 → CaSO4 +H2O +CO2 (4) 2H2SO4 + Cu → CuSO4 +H2O +SO2 Các phản ứng mà H2SO4 thể hiện tính axit là A.(1),(2),(4) B.(2),(3),(4) C.(1),(2),(3) D.(1),(2) Câu 18:Nhóm chất nào sau đây phản ứng với dung dịch axit H2SO4 loãng? A.Zn,CuO,BaSO4 B.Mg,CaO,Na2CO3 C.Ag,NaOH,FeO D.Al,NaCl,Na2O Câu 19:Hoà tan hoàn toàn 1,6 gam hỗn hợp X gồm Mg và Fe trong axit H2SO4 loãng thì thu được 0,896 lít khí H2(đktc).Khối lượng muối sunfat thu được là A. 3,84 gam B.5,44 gam C.3,04 gam D.2,4 gam Câu 20: Hoà tan hoàn toàn 3,6 gam một miếng kim loại (hóa tri 2) trong dung dịch axit H2SO4 loãng,thấy thoát ra 3,36 lít khí H2(đktc). Đó là kim loại nào? A.Mn B.Zn C.Fe D.Mg II.Tự luận(2 đ) Câu 1:Có 3 dung dịch là H2SO4,HCl và NaCl chứa riêng biệt trong các lọ mất nhãn.Trình bày phương pháp hóa học để phân biệt 3 dung dịch trên Câu 2: Hòa tan hoàn toàn 22 gam hỗn hợp X gồm hai kim loại là Al và Fe trong dung dịch axxit H2SO4 đặc Nóng thấy thoát ra 20,16 lít khí SO2(đktc).Tính phần trăm khối lượng của Al trong hỗn hợp X HẾT II.Đáp án tự luận Nội dung Điểm Câu 1 Dùng quì tím nhận biết NaCl Dùng BaCl2 nhận biết H 2SO4 (kết tủa trắng) H2SO4 + BaCl2 →BaSO4↓ + 2HCl Còn lại là HCl 0,25 0,25 0,25 0,25 Câu 2 Số mol SO2 = 20,16/22,4= 0,9 mol 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O x (3/2).x (mol) 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O y (3/2).y (mol) 27x + 56y = 22 3/2x + 3/2.y = 0,9 X=0,4 Y= 0,2 % Al= ((27.0,4)/22).100= 49,09% 0,1 0,2 0,2 0,25 0,25
Tài liệu đính kèm:
 kiem_tra_1_tiet_so_4_mon_hoa_hoc_10_co_ban.doc
kiem_tra_1_tiet_so_4_mon_hoa_hoc_10_co_ban.doc





