Kiểm tra 1 tiết lớp 10 lần 4 - Môn Hóa 10
Câu 1(biết): Người ta điều chế oxi trong phòng thí nghiệm bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng. B. Điện phân nước.
C. Điện phân dung dịch NaOH. D. Nhiệt phân KMnO4.
Câu 2(biết): Hãy chỉ ra nhận xét sai, khi nói về oxi và ozon:
A. O2 phản ứng trực tiếp với hầu hết kim loại. B. O3 có tính oxi hóa mạnh hơn O2
C. O2 tham gia vào quá trình xảy ra sự cháy, sự gỉ, sự hô hấp.
D. Không thể phân biệt oxi và ozon vì oxi và ozon là 2 dạng thù hình của nhau.
Câu 3 (biết): Ozon không có ứng dụng nào sau đây?
A. Tẩy trắng tinh bột, dầu ăn B. Chữa sâu răng C. Bảo quản thực phẩm D. Sát trùng nước sinh hoạt
Câu 4: (hiểu) Bể nuôi tôm, cá thường sử dụng hệ thống sục khí là do oxi có tính chất:
A. Tan nhiều trong nước
B. Tan ít trong nước
C. Không tan trong nước
D. Chất khí, không màu, không mùi
Câu 5 (hiểu): Cho các phản ứng sau :
(1) O2 + S ® SO2 ; (2) O2 + Cl2® 2Cl2O; (3) 5O2 + 4P ® 2P2O5 ;
(4) O2 + 2CO ® 2CO2 ; (5) O2 + 4Au ® 2Au2O ; (6) 2O2 + 3Fe ® Fe3O4
Phản ứng đúng là :
A. 1, 3, 4, 6. B.1, 2, 4, 5. C. 1, 2, 5, 6. D. 1, 3, 4, 5.
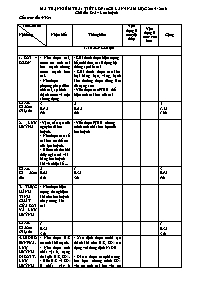
MA TRẬN KIỂM TRA 1 TIẾT LỚP 10CB LẦN 4 NĂM HỌC 2015 - 2016 Chủ đề: Oxi – Lưu huỳnh Cấu trúc đề: 4-3-2-1 Tên Chủ đề Nội dung Nhận biết Thông hiểu Vận dụng ở mức độ thấp Vận dụng ở mức cao hơn Cộng I. TRẮC NGHIỆM 1. OXI – OZON - Nêu được oxi, ozon có tính oxi hóa mạnh nhưng ozon mạnh hơn oxi. - Nêu được phương pháp điều chế oxi, sự hình thành ozon và một sốứng dụng - Giải thích được hiện tượng bể nuôi tôm, cá sử dụng hệ thống sục khí oxi - Giải thích được các kim loại bằng bạc, vàng, bạch kim thường được dùng làm đồ trang sức - Viết được các PTHH thể hiện tính oxi hóa của oxi Số câu Số điểm (Tỉ lệ %) 3 0,9 đ 9% 2 0,6 đ 6% 5 1,5đ 15% 2. LƯU HUỲNH -Vị trí, cấu tạo của nguyên tử lưu huỳnh. - Nêu được các số oxi hóa có thể có của lưu huỳnh. - Biết cách thu hồi thủy ngân rơi vãi bằng lưu huỳnh khi vỡ nhiệt kế ... - Viết được PTHH chứng minh tính chất hóa học của lưu huỳnh Số câu Số điểm (%) 2 0,6đ 6 % 1 0,3đ 3% 3 0,9đ 9% 3. THỰC HÀNH TÍNH CHẤT CỦA OXI VÀ LƯU HUỲNH - Nêu được hiện tượng thí nghiệm khi cho lưu huỳnh cháy trong khí oxi Số câu Số điểm (Tỉ lệ %) 1 0,3đ 3 % 1 0,3đ 3 % 4. HIĐRO SUNFUA. LƯU HUỲNH ĐIOXIT. LƯU HUỲNH TRIOXIT - Nêu được H2S có tính khử mạnh. - Nêu được tính chất vật lí, trạng thái của H2S, SO2. - Biết H2S và SO2 là chất gây ô nhiễm môi trường - Xác định được muối tạo thành khi cho H2S, SO2 tác dụng với dung dịch NaOH - Dẫn ra được các phản ứng hóa học chứng minh SO2 vừa có tính oxi hoá vừa có tính khử Số câu Số điểm (Tỉ lệ %) 3 0,9 đ 9 % 2 0,6 đ 6 % 5 1,5 đ 15 % 5.AXIT SUNFURIC- MUỐI SUNFAT - Biết cách pha loãng axit sunfuric - Biết được thiết bị bằng kim loại chuyên chở axit sunfuric đặc, nguội - Nêu được một số tính chất của muối sunfat, phương pháp nhận biết ion sunfat -Nêu được tính háo nước của axit sunfuric đặc - Dẫn ra được các phương trình hóa học minh họa tính axit, tính oxi hóa mạnh của axit sunfuric - Phân biệt, nhận biết được dung dịch chứa ion sunfat với các dung dịch khác Số câu Số điểm (%) 3 0,9 đ 9% 2 0,6 đ 6% 5 1,5 đ 15% 6. THỰC HÀNH TÍNH CHẤT CÁC HỢP CHẤT CỦA LƯU HUỲNH - Nêu được hiện tượng khi cho SO2 phản ứng với dung dịch brom,axit sunfuric đặc phản ứng với Cu Số câu Số điểm (Tỉ lệ %) 1 0,3 đ 3% 1 0,3 đ 3% Số câu Số điểm (Tỉ lệ %) 13 3,9 đ 39 % 7 2,1 đ 21% 20 6 đ 60% II. TỰ LUẬN Câu 1 Viết phương trình hóa học minh họa tính chất của O2,S, H2S, SO2, SO3, H2SO4 (1 điểm) Câu 2 Bài toán tính % thể tích khí trong hỗn hợp áp dụng sơ đồ đường chéo (1 điểm) Câu 3 a, Tính được thành phần % khối lượng mỗi kim loại hoặc hợp chất và kl hoặc hợp chất trong hỗn hợp khi cho hỗn hợp tác dụng với axit H2SO4 (1 điểm) b. Giải được bài toán kim loại phản ứng với axit sunfuric đặc khi áp dụng định luật bảo toàn electron (1 điểm) Số câu Số điểm (Tỉ lệ %) 1 1,0 10% 2 2,0 20% 1 1,0 10% 4 4,0 40% Tổng Số điểm (Tỉ lệ %) 3,9 39% 3,1 41% 2,0 20% 1,0 10% 10,0 100% I. TRẮC NGHIỆM Câu 1(biết): Người ta điều chế oxi trong phòng thí nghiệm bằng cách nào sau đây? A. Chưng cất phân đoạn không khí lỏng. B. Điện phân nước. C. Điện phân dung dịch NaOH. D. Nhiệt phân KMnO4. Câu 2(biết): Hãy chỉ ra nhận xét sai, khi nói về oxi và ozon: A. O2 phản ứng trực tiếp với hầu hết kim loại. B. O3 có tính oxi hóa mạnh hơn O2 C. O2 tham gia vào quá trình xảy ra sự cháy, sự gỉ, sự hô hấp. D. Không thể phân biệt oxi và ozon vì oxi và ozon là 2 dạng thù hình của nhau. Câu 3 (biết): Ozon không có ứng dụng nào sau đây? A. Tẩy trắng tinh bột, dầu ăn B. Chữa sâu răng C. Bảo quản thực phẩm D. Sát trùng nước sinh hoạt Câu 4: (hiểu) Bể nuôi tôm, cá thường sử dụng hệ thống sục khí là do oxi có tính chất: A. Tan nhiều trong nước B. Tan ít trong nước C. Không tan trong nước D. Chất khí, không màu, không mùi Câu 5 (hiểu): Cho các phản ứng sau : (1) O2 + S ® SO2 ; (2) O2 + Cl2® 2Cl2O; (3) 5O2 + 4P ® 2P2O5 ; (4) O2 + 2CO ® 2CO2 ; (5) O2 + 4Au ® 2Au2O ; (6) 2O2 + 3Fe ® Fe3O4 Phản ứng đúng là : A. 1, 3, 4, 6. B.1, 2, 4, 5. C. 1, 2, 5, 6. D. 1, 3, 4, 5. Câu 6: (biết) Cho các câu sau: Khí H2S mùi trứng thối, rất độc. (1) Khí H2S tan trong nước tạo dung dịch axit yếu (2) H2S có tính oxi hóa yếu (3) H2S có tính khử mạnh (4) Số phát biểu đúng là: A. 1 B. 2 C. 3 D. 4 Câu 7 (biết): Để thu hồi thủy ngân trong nhiệt kế khi bị rơi vãi ra ngoài ta phải: A. Rắc muối ăn NaCl B. Nhỏ dung dịch brom C. Rắc bột lưu huỳnh D. Rắc bột photpho Câu 8 (hiểu): Phản ứng S thể hiện tính oxi hóa là: A. S + 2H2SO4 → 3SO2 + 2H2O B. S + H2® H2S C. S + 3F2® SF6 D. S + O2® SO2 Câu 9 (biết): Hiện tượng quan sát được khi cho lưu huỳnh cháy trong bìnhđựng khí oxi là: A. Lưu huỳnh cháy chậm, cho ngọn lửa có màu xanh B. Lưu huỳnh cháy sáng, cho ngọn lửa có màu xanh C. Lưu huỳnh cháy sáng, cho ngọn lửa có màu vàng D. Lưu huỳnh cháy chậm, cho ngọn lửa có màu vàng Câu 10 (biết): Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng. A. Chuyển thành màu nâu đỏ. B. Bị vẩn đục có màu vàng. C. Vẫn trong suốt không màu D. Xuất hiện chất rắn màu đen Câu 11(biết):Chất nào dưới đây góp phần nhiều nhất vào sự tạo thành mưa axit? A. cacbon đioxit B. lưu huỳnhđioxit C. Ozon D. CFC Câu 12(biết): Chọn khẳng định đúng: A. Hiđro sunfua là một chất oxi hoá mạnh.B. Hiđro sunfua là một chất vừa có tính oxi hóa, vừa có tính khử. C. Dung dịch H2S là một axít mạnh. D. Hiđro sunfua là một chất khử mạnh. Câu 13 (hiểu) : Cho phản ứng: SO2 + 2H2S → 3S + 2H2O Trong phản ứng này, vai trò của SO2 là: A. Chất oxi hoá B. vừa là chất oxi hoá vừa là chất khử C. Chất khử D. Chất xúc tác Câu 14: (hiểu) Sục từ từ 2,24 lit SO2 (đkc) vào 100 ml dung dịch NaOH 1,5M. Muối được tạo thành có trong dung dịch sau phản ứng là: A. Na2SO4, NaHSO4 B. NaHSO3.C. Na2SO3 D. Na2SO3, NaHSO3 Câu 15: (biết) Để chuyên chở axit sunfuric đặc, nguội người ta thường dùng các bình làm bằng: A. Sắt, nhôm B. Sắt, kẽm C. Nhôm, kẽm D. Đồng, kẽm Câu 16: (biết) Chọn ýkhông đúngkhi nóivề H2SO4: A. H2SO4 đặc là chất hút nước mạnh. B. Khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng. C. H2SO4 loãng có đầy đủ tính chất chung của axit. D. Khi pha loãng axit sunfuric, chỉ được cho từ từ nước vào axit. Câu 17: (biết)Phát biểu nào sau đây sai? A. SO2 vừa có tính khử vừa có tính oxi hóa B. SO2 là khí gây ra hiệu ứng nhà kính C. SO2 là khí có mùi hắc D. S là chất rắn màu vàng Câu 18: (hiểu) Nhận biết các dung dịch mất nhãn:H2SO4, NaOH, Na2SO4, HNO3, NaNO3 ta dùng : A. dd HCl , quì tím B. Quì tím, dd Ba(NO3)2 C. Quì tím, dd H2S D. Phenolphtalein, dd BaCl2 Câu 19 (hiểu) Chọn phản ứng không đúng trong các phản ứng sau đây: A. H2SO4 đặc + FeO ->FeSO4 + H2O B. H2SO4 đặc + 2HI ->I2 + SO2 + 2H2O C. 2H2SO4 đặc + C -> CO2 + 2SO2 + 2H2O D. 6H2SO4 đăc, nóng + 2Fe ->Fe2(SO4)3 + 3SO2 + 6H2O Câu 20: (biết) Hiện tượng quan sát được khi cho Cu vào ống nghiệm chứa axit H2SO4 đặc,nóng là: A. Không có hiện tượng gì xảy ra B. Xuất hiện kết tủa trắng đục C. Có khí không màu không mùi thoát ra, dung dịch có màu xanh lam D. Có khí mùi hắc thoát ra, dung dịch có màu xanh lam II. TỰ LUẬN: Câu 1: (1 điểm) Hoàn thành chuỗi phản ứng: Câu 2: (1 điểm) Tỉ khối của hỗn hợp X gồm O2 và O3 so với H2 là 18. Tính phần trăm thể tích của O2 và O3 có trong hỗn hợp X. Câu 3: (2 điểm) Cho 18,4 g hỗn hợp X gồm FeO và Fe tác dụng hết với dung dịch axit H2SO4 loãng thu được 4,48 lít khí (đktc) a. Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp X. b. Nếu cho 18,4 g hỗn hợp X tác dụng hoàn toàn với axit H2SO4 đặc, nóng thì thể tích khí SO2 (đktc) thu được là bao nhiêu?
Tài liệu đính kèm:
 kiem_tra_1_tiet_lop_10_lan_4_mon_hoa_10.doc
kiem_tra_1_tiet_lop_10_lan_4_mon_hoa_10.doc





