Đề kiểm tra chương 2 môn Hóa học 11
Câu 1: Hoàn thành các phương trình hoá học sau:
a) KNO3 .
b) Zn(NO3)2 .
Câu 2: Axit nitric thể hiện tính oxi hoá khi tác dụng với chất nào sau đây?
a) CuO; Mg; Fe2O3; P .
b) S; CaO; FeO; Au .
Câu 3: Bằng phương pháp hoá học hãy nhận biết các dung dịch đựng trong các lọ mất nhãn sau: NaOH; HCl; Na3PO4; NaNO3
Câu 4: Viết phương trình hoá học hoàn thành dãy chuyển hoá sau (ghi rõ điều kiện nếu có):
Câu 5: Viết phương trình phân tử và ion thu gọn của phản ứng giữa:
a) Dung dịch NH3 và dung dịch AlCl3
b) Dung dịch axit nitric và dung dịch NaOH
Câu 6: Xác định số oxi hoá của Nitơ trong: N2O; HNO3; NO2;
Câu 7: Cho 0,1 mol H3PO4 vào 0,2 mol dung dịch NaOH. Sau khi phản ứng xảy ra, muối nào được tạo thành? Khối lượng là bao nhiêu?
Câu 8: Cho 13,05 gam hỗn hợp kim loại Mg và Al vào dung dịch HNO3 loãng, dư thu được 10,08 lít một chất khí không màu, hoá nâu đỏ ngoài không khí (đkc). Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp?
Câu 9: Tính khối lượng nitơ trong 8 kg phân đạm amoni nitrat?
Câu 10: Hoà tan hoàn toàn 5,94 gam kim loại R có hoá trị III trong dung dịch HNO3 loãng, thu được 2,688 lit hỗn hợp khí (đkc) gồm NO và N2O có tỉ khối hơi so với hiđro là 18,5. Xác định kim loại R?
(Cho: Al=27; Mg=24; H=1; O=16; N=14; P=31; Na=23)
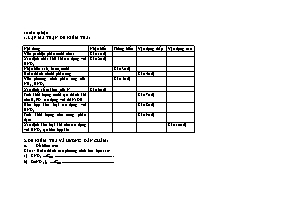
10 câu tự luận 1. LẬP MA TRẬN ĐỀ KIỂM TRA: Nội dung Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Viết pt nhiệt phân muối nitrat Câu 1(1đ) Xác định chất khử khi tác dụng với HNO3 Câu 2(1đ) Nhận biết axit, bazơ, muối Câu 3(1đ) Hoàn thành chuỗi phản ứng Câu 4(1đ) Viết phương trình phản ứng của NH3, HNO3 Câu 5(1đ) Xác định số oxi hoá của N Câu 6(1đ) Tính khối lượng muối tạo thành khi cho H3PO4 tác dụng với dd NaOH Câu 7(1đ) Hỗn hợp kim loại tác dụng với HNO3 Câu 8(1đ) Tính khối lượng nitơ trong phân đạm Câu 9(1đ) Xác định kim loại khi cho tác dụng với HNO3 tạo hỗn hợp khí Câu 10(1đ) 2. ĐỀ KIỂM TRA VÀ HƯỚNG DẪN CHẤM: Đề kiểm tra: Câu 1: Hoàn thành các phương trình hoá học sau: a) KNO3 .......................................................... b) Zn(NO3)2 .................................................... Câu 2: Axit nitric thể hiện tính oxi hoá khi tác dụng với chất nào sau đây? CuO; Mg; Fe2O3; P .............................................. S; CaO; FeO; Au ............................................. Câu 3: Bằng phương pháp hoá học hãy nhận biết các dung dịch đựng trong các lọ mất nhãn sau: NaOH; HCl; Na3PO4; NaNO3 Câu 4: Viết phương trình hoá học hoàn thành dãy chuyển hoá sau (ghi rõ điều kiện nếu có): Câu 5: Viết phương trình phân tử và ion thu gọn của phản ứng giữa: a) Dung dịch NH3 và dung dịch AlCl3 b) Dung dịch axit nitric và dung dịch NaOH Câu 6: Xác định số oxi hoá của Nitơ trong: N2O; HNO3; NO2; Câu 7: Cho 0,1 mol H3PO4 vào 0,2 mol dung dịch NaOH. Sau khi phản ứng xảy ra, muối nào được tạo thành? Khối lượng là bao nhiêu? Câu 8: Cho 13,05 gam hỗn hợp kim loại Mg và Al vào dung dịch HNO3 loãng, dư thu được 10,08 lít một chất khí không màu, hoá nâu đỏ ngoài không khí (đkc). Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp? Câu 9: Tính khối lượng nitơ trong 8 kg phân đạm amoni nitrat? Câu 10: Hoà tan hoàn toàn 5,94 gam kim loại R có hoá trị III trong dung dịch HNO3 loãng, thu được 2,688 lit hỗn hợp khí (đkc) gồm NO và N2O có tỉ khối hơi so với hiđro là 18,5. Xác định kim loại R? (Cho: Al=27; Mg=24; H=1; O=16; N=14; P=31; Na=23) Hướng dẫn chấm: Câu 1: a) 2KNO3 2KNO2 + O2 b) 2Zn(NO3)2 2ZnO + 4NO2 + O2 Câu 2: Mg, P S, FeO Câu 3: Quì tím: Nhận biết axit, bazơ Dung dịch AgNO3: Nhận biết muối photphat Câu 4: Câu 5: a) 3NH3 + AlCl3 + 3H2O → Al(OH)3 + 3NH4Cl 3NH3 + Al3+ + 3H2O → Al(OH)3 + 3NH4 b) HCl + NaOH à NaCl + H2O H+ + OH- → H2O Câu 6: Xác định số oxi hoá của Nitơ trong: Câu 7: Ta có: à Tạo muối Na2HPO4 H3PO 4 + 2NaOH → Na2HPO4 + 2H2O 0,1mol 0,1mol à Câu 8: Ta có: ; Số mol khí = 10,08/22,4= 0,45(mol) Mg → Mg2+ + 2e Al→ Al3+ +3e O3- + 4H+ + 3e → O + 2H2O x 2x y 3y 1,35mol ß 0,45mol Tổng số e cho = Tổng số e nhận nên: 2x + 3y = 1,35 (2) Từ (1) và (2) ta có hệ phương trình: à à mMg = 24.0,15 = 3,6 (g); Câu 9: Trong 80 g NH4NO3 có 28 g Nitơ 8 g → x gam à Câu 10: Gọi x, y là số mol NO và N2O, ta có: x + y = 2,688/22,4= 0,12 (1) Từ (1) và (2) ta có x=y=0,06 (mol) R + 4HNO3 → R(NO3)3 + NO + 2H2O 8R + 30HNO3 → 8R(NO3)3 + 3N2O + 15H2O x x 8y/3 y Tổng số mol R= x + 8y/3 = 0,06 + 8.0,06/3 = 0,22 (mol) à R = 5,94/0,22 = 27 Vậy R là Al KẾT QUẢ KIỂM TRA VÀ RÚT KINH NGHIỆM: Kết quả kiểm tra: Lớp 0à<3,5 3,5à<5 5à<6,5 6,5à<8 8à10 11A1
Tài liệu đính kèm:
 DE_KIEM_TRA_CHUONG_2_10_cau_tu_luan.doc
DE_KIEM_TRA_CHUONG_2_10_cau_tu_luan.doc





