Đề kiểm tra 1 tiết lần 3 - Môn: Hóa học 10
Câu 1: (1 điểm) Viết công thức hóa học của các hợp chất:
a) Clorua vôi; b) Silic tetraflorua; c) Axit hipobromơ; d) Axit iothidric;
Câu 2: (1 điểm) Cho bảng số liệu trạng thái tập hợp của đơn chất ở 200C và màu sắc của các halogen có trong tự nhiên như sau:
Trạng thái, màu sắc Rắn, màu đen tím Khí, màu vàng lục Khí, màu lục nhạt Lỏng, màu nâu đỏ
Nguyên tố X Y Z T
Xác định tên nguyên tố X, Y, Z, T.
Câu 3: (1 điểm)
a) Nêu 2 ứng dụng của nước Gia-ven mà em biết và viết phương trình phản ứng điều chế nước Gia-ven trong phòng thí nghiệm.
b) Viết phương trình hóa học của phản ứng xảy ra khi cho đồng tác dụng với clo và sắt (III) hidroxit tác dụng với dung dịch axit clohidric.
Câu 4: (1 điểm) Tiến hành thí nghiệm sau: Lấy một bình đã thu đầy khí hidro clorua và đậy bình bằng nút cao su. Xuyên qua nút có một ống thủy tinh thẳng, vuốt nhọn ở đầu. Nhúng ống thủy tinh vào một chậu chứa nước có pha vài giọt dung dịch quỳ tím.
a) Nêu hiện tượng quan sát được.
b) Giải thích.
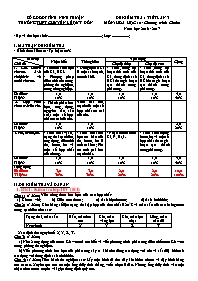
SỞ GD&ĐT TỈNH NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN ĐỀ KIỂM TRA 1 TIẾT LẦN 3 MÔN: HÓA HỌC 10 - Chương trình Chuẩn Năm học 2016 - 2017 - Họ và tên học sinh:......................................................; Lớp: .................; I. MA TRẬN ĐỀ KIỂM TRA - Hình thức kiểm tra: Tự luận 100% Mức độ Chủ đề Nhận biết Thông hiểu Vận dụng Cộng Cấp độ thấp Cấp độ cao 1. Clo. Hidro clorua. Axit clohidric và muối clorua. - Tính chất hóa học của Cl 2, HCl. - Phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp. - Dung dịch HCl là một axit mạnh, có tính khử. - Tính nồng độ hoặc thể tích của Cl 2, dung dịch axit HCl tham gia hoặc tạo thành trong phản ứng. - Tính nồng độ hoặc thể tích của Cl 2, dung dịch axit HCl tham gia hoặc tạo thành trong phản ứng. Số điểm: Tỉ lệ%: 1,0 10% 1,0 10% 1,0 10% 1,0 10% 4,0 40% 2. Hợp chất chứa oxi của clo. - Thành phần hóa học, ứng dụng, nguyên tắc sản xuất một số hợp chất có oxi của clo. -Tính oxi hoá mạnh của một số hợp chất có oxi của clo. Số điểm: Tỉ lệ%: 1,0 10% 1,0 10% 2,0 20% 3. Flo, brom, iot. - Tính chất vật lí, trạng thái tự nhiên, ứng dụng, điều chế flo, brom, iot và một số hợp chất của chúng. - Tính chất hoá học cơ bản của flo, brom, iot là tính oxi hoá; Flo có tính oxi hoá mạnh nhất. - Nhận biết các ion Cl-, F-, Br, I-. - Tính khối lượng brom, iot và một số hợp chất tham gia hoặc tạo thành trong phản ứng. Số điểm: Tỉ lệ%: 1,0 10% 1,0 10% 1,0 10% 1,0 10% 4,0 40% Tổng cộng Số điểm: Tỉ lệ%: 3,0 30% 3,0 30% 2,0 20% 2,0 20% 10,0 100% II. ĐỀ KIỂM TRA VÀ ĐÁP ÁN 1. ĐỀ 1: Kiểm tra lớp 10V (H1) Câu 1: (1 điểm) Viết công thức hóa học của các hợp chất: a) Clorua vôi; b) Silic tetraflorua; c) Axit hipobromơ; d) Axit iothidric; Câu 2: (1 điểm) Cho bảng số liệu trạng thái tập hợp của đơn chất ở 200C và màu sắc của các halogen có trong tự nhiên như sau: Trạng thái, màu sắc Rắn, màu đen tím Khí, màu vàng lục Khí, màu lục nhạt Lỏng, màu nâu đỏ Nguyên tố X Y Z T Xác định tên nguyên tố X, Y, Z, T. Câu 3: (1 điểm) a) Nêu 2 ứng dụng của nước Gia-ven mà em biết và viết phương trình phản ứng điều chế nước Gia-ven trong phòng thí nghiệm. b) Viết phương trình hóa học của phản ứng xảy ra khi cho đồng tác dụng với clo và sắt (III) hidroxit tác dụng với dung dịch axit clohidric. Câu 4: (1 điểm) Tiến hành thí nghiệm sau: Lấy một bình đã thu đầy khí hidro clorua và đậy bình bằng nút cao su. Xuyên qua nút có một ống thủy tinh thẳng, vuốt nhọn ở đầu. Nhúng ống thủy tinh vào một chậu chứa nước có pha vài giọt dung dịch quỳ tím. a) Nêu hiện tượng quan sát được. b) Giải thích. Câu 5: (1 điểm) Viết các phương trình hóa học để hoàn thành chuỗi biết hóa sau: NaCl HCl Cl2 FeCl3 Fe(NO3)3 Câu 6: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các lọ hóa chất chưa dán nhãn chứa riêng biệt các dung dịch sau: CaCl2, KI, NaF. Viết phương trình hóa học của các phản ứng xảy ra. Câu 7: (1 điểm) Cần dùng 250 ml dung dịch HCl aM để kết tủa hoàn toàn 100 gam dung dịch AgNO3 8,5%. Tìm giá trị a. Câu 8: (1 điểm) Cho 20,8 gam Zn tác dụng với Br2 dư trong điều kiện thích hợp thu được m gam muối ZnBr2. Tìm giá trị m. Biết hiệu suất phản ứng đạt 85%. Câu 9: (1 điểm) Hòa tan hoàn toàn 1,38 gam hỗn hợp X gồm Fe và Al trong dung dịch HCl dư thu được 1,008 lít khí H2 (đktc). Tính khối lượng mỗi kim loại có trong hỗn hợp X. Câu 10: (1 điểm) Cho 52,2 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 10,752 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. (Cho nguyên tử khối của: H = 1; N = 14; O = 16; Al = 27; Cl = 35,5; Mn = 55; Fe = 56; Zn = 65; Br = 80; Ag = 108) ----------HẾT---------- HƯỚNG DẪN CHẤM ĐỀ 1 NỘI DUNG ĐIỂM Câu 1: Viết công thức hóa học của các hợp chất: a) Clorua vôi; b) Silic tetraflorua; c) Axit hipobromơ; d) Axit iothidric; a) CaOCl2; b) SiF4; c) HBrO; d) HI; 0,25/chất Câu 2: (1 điểm) Cho bảng số liệu trạng thái tập hợp của đơn chất ở 200C và màu sắc của các halogen có trong tự nhiên như sau: Trạng thái, màu sắc Rắn, màu đen tím Khí, màu vàng lục Khí, màu lục nhạt Lỏng, màu nâu đỏ Nguyên tố X Y Z T Xác định tên nguyên tố X, Y, Z, T. Nhận xét: Nhiệt độ nóng chảy của các halogen tăng dần khi đi từ flo đến iot, nên: X là Iot; Y là Clo; Z là Flo và T là Brom 0,25/tên Câu 3: a) Nêu 2 ứng dụng của nước Gia-ven mà em biết và viết phương trình phản ứng điều chế nước Gia-ven trong phòng thí nghiệm. b) Viết phương trình hóa học của phản ứng xảy ra khi cho đồng tác dụng với clo và sắt (III) hidroxit tác dụng với dung dịch axit clohidric. a) - Tẩy trắng vải sợi. - Tầy uế chuồng trại chăn nuôi. 0,25 0,25 b) Cl2 + 2NaOH NaClO + NaCl + H2O 0,5 Câu 4: Tiến hành thí nghiệm sau: Lấy một bình đã thu đầy khí hidro clorua và đậy bình bằng nút cao su. Xuyên qua nút có một ống thủy tinh thẳng, vuốt nhọn ở đầu. Nhúng ống thủy tinh vào một chậu chứa nước có pha vài giọt dung dịch quỳ tím. a) Nêu hiện tượng quan sát được. b) Giải thích. a) Một lát sau, nước trong chậu theo ống phun vào bình thành những tia nước màu đỏ. 0,5 b) Vì khí hidro clorua tan nhiều trong nước, tạo ra sự giảm mạnh áp suất trong bình, áp suất của khí quyển đẩy nước vào thế chỗ khí hidro clorua đã hòa tan. 0,5 Câu 5: Viết các phương trình hóa học để hoàn thành chuỗi biết hóa sau: NaCl HCl Cl2 FeCl3 Fe(NO3)3 (1) NaCl + H2SO4 (đ) HCl + NaHSO4 0,25 (2) MnO2 + 4HCl MnCl2 + Cl2 + 2H2O 0,25 (3) 3Cl2 + 2Fe 2FeCl3 0,25 (4) FeCl3 + 3AgNO3 3AgCl + Fe(NO3)3 0,25 Câu 6: Bằng phương pháp hóa học hãy nhận biết các lọ hóa chất chưa dán nhãn chứa riêng biệt các dung dịch sau: CaCl2, KI, NaF. Viết phương trình hóa học của các phản ứng xảy ra. - Thuốc thử: dung dịch AgNO3 0,25 - Mẫu có kết tủa trắng là dung dịch CaCl2 CaCl2 + 2AgNO3 2AgCl + Ca(NO3)2 0,25 - Mẫu có kết tủa vàng là dung dịch KI KI + AgNO3 AgI + KNO3 0,25 - Mẫu không có hiện tượng là dung dịch NaF 0,25 Câu 7: Cần dùng 250 ml dung dịch HCl aM để kết tủa hoàn toàn 100 gam dung dịch AgNO3 8,5%. Tìm giá trị a. - Số mol AgNO3 mol 0,25 - PTHH: HCl + AgNO3 AgCl + HNO3 (mol) 0,05 0,05 0,5 (M) 0,25 Câu 8: Cho 20,8 gam Zn tác dụng với Br2 dư trong điều kiện thích hợp thu được m gam muối ZnBr2. Tìm giá trị m. Biết hiệu suất phản ứng đạt 85%. - Số mol Zn = 0,32 mol 0,25 - Theo lý thuyết: mol 0,25 - Vì hiệu suất phản ứng chỉ đạt 85% nên thực tế mol 0,25 gam 0,25 Câu 9: Hòa tan hoàn toàn 1,38 gam hỗn hợp X gồm Fe và Al trong dung dịch HCl dư thu được 1,008 lít khí H2 (đktc). Tính khối lượng mỗi kim loại có trong hỗn hợp X. - Gọi a, b lần lượt là số mol của Fe và Al có trong hỗn hợp 56a + 27b = 1,38 (1) - PTHH: Fe + 2HCl FeCl2 + H2 2Al + 6HCl 2AlCl3 + 3H2 - Từ 2 PTHH trên có: a + 1,5b = (2) 0,5 - Giải (1) và (2) được: a = 0,015 và b = 0,02 - Vậy mFe = 0,015.56 = 0,84 gam và mAl = 1,38 0,84 = 0,54 gam 0,5 Câu 10: Cho 52,2 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 10,752 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. - Số mol MnO2 = 0,6 mol; Số mol Cl2 = 0,48 mol 0,25 - PTHH: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O - Nhận xét: MnO2 dư 0,25 - mol 0,25 gam 0,25 2. ĐỀ 2: Kiểm tra lớp 10T, 10A1 (H2) ĐỀ 2A Câu 1: (1 điểm) Viết công thức hóa học của các hợp chất: a) Nhôm iotua; b) Silic tetraflorua; c) Axit hipobromơ; d) Criolit; Câu 2: (1 điểm) Cho bảng số liệu về nhiệt độ nóng chảy của các halogen có trong tự nhiên như sau: Nhiệt độ nóng chảy (0C) 113,6 -101,0 -7,3 -219,6 Nguyên tố X Y Z T Xác định tên nguyên tố X, Y, Z, T. Câu 3: (1 điểm) a) Viết 2 phương trình phản ứng dùng để sản xuất axit clohidric trong công nghiệp. b) Viết phương trình hóa học của phản ứng xảy ra khi cho sắt tác dụng với clo và sắt tác dụng với dung dịch axit clohidric. Câu 4: (1 điểm) Tiến hành thí nghiệm sau: Lấy một bình đã thu đầy khí hidro clorua và đậy bình bằng nút cao su. Xuyên qua nút có một ống thủy tinh thẳng, vuốt nhọn ở đầu. Nhúng ống thủy tinh vào một chậu chứa nước có pha vài giọt dung dịch quỳ tím. a) Nêu hiện tượng quan sát được. b) Giải thích. Câu 5: (1 điểm) a) Viết phương trình phản ứng chứng minh axit clohidric có tính khử. b) Tại sao không được dùng lọ thủy tinh để chứa dung dịch axit flohidric? Giải thích và viết phương trình hóa học của phản ứng xảy ra. Câu 6: (1 điểm) So sánh tính oxi hóa của brom và iot. Viết phương trình hóa học chứng minh. Câu 7: (1 điểm) Cần dùng 200 ml dung dịch HCl aM để kết tủa hoàn toàn 200 gam dung dịch AgNO3 8,5%. Tìm giá trị a. Câu 8: (1 điểm) Cho 15,36 gam Cu tác dụng với Br2 dư trong điều kiện thích hợp thu được m gam muối CuBr2. Tìm giá trị m. Biết hiệu suất phản ứng đạt 90%. Câu 9: (1 điểm) Hòa tan hoàn toàn 0,63 gam hỗn hợp X gồm Mg và Al trong dung dịch HCl dư thu được 0,672 lít khí H2 (đktc). Tính khối lượng mỗi kim loại có trong hỗn hợp X. Câu 10: (1 điểm) Cho 69,6 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 13,44 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. (Cho nguyên tử khối của: H = 1; N = 14; O = 16; Mg = 24; Al = 27; Cl = 35,5; Mn = 55; Cu = 64; Br = 80; Ag = 108) ----------HẾT---------- HƯỚNG DẪN CHẤM ĐỀ 2A NỘI DUNG ĐIỂM Câu 1: Viết công thức hóa học của các hợp chất: a) Nhôm iotua; b) Silic tetraflorua; c) Axit hipobromơ; d) Criolit; a) AlI3; b) SiF4; c) HBrO; d) Na3AlF6; 0,25/chất Câu 2: Cho bảng số liệu về nhiệt độ nóng chảy của các halogen có trong tự nhiên như sau: Nhiệt độ nóng chảy (0C) 113,6 -101,0 -7,3 -219,6 Nguyên tố X Y Z T Xác định tên nguyên tố X, Y, Z, T. Nhận xét: Nhiệt độ nóng chảy của các halogen tăng dần khi đi từ flo đến iot, nên: X là Iot; Y là Clo; Z là Brom và T là Flo 0,25/tên Câu 3: a) Viết 2 phương trình phản ứng dùng để sản xuất axit clohidric trong công nghiệp. b) Viết phương trình hóa học của phản ứng xảy ra khi cho sắt tác dụng với clo và sắt tác dụng với dung dịch axit clohidric. a) H2 + Cl2 2HCl 2NaCl + H2SO4 Na2SO4 + 2HCl 0,25 0,25 b) 2Fe + 3Cl2 2FeCl3 Fe + 2HCl FeCl2 + H2 0,25 0,25 Câu 4: Tiến hành thí nghiệm sau: Lấy một bình đã thu đầy khí hidro clorua và đậy bình bằng nút cao su. Xuyên qua nút có một ống thủy tinh thẳng, vuốt nhọn ở đầu. Nhúng ống thủy tinh vào một chậu chứa nước có pha vài giọt dung dịch quỳ tím. a) Nêu hiện tượng quan sát được. b) Giải thích. a) Một lát sau, nước trong chậu theo ống phun vào bình thành những tia nước màu đỏ. 0,5 b) Vì khí hidro clorua tan nhiều trong nước, tạo ra sự giảm mạnh áp suất trong bình, áp suất của khí quyển đẩy nước vào thế chỗ khí hidro clorua đã hòa tan. 0,5 Câu 5: a) Viết phương trình phản ứng chứng minh axit clohidric có tính khử. b) Tại sao không được dùng lọ thủy tinh để chứa dung dịch axit flohidric? Giải thích và viết phương trình hóa học của phản ứng xảy ra. a) MnO2 + 4HCl MnCl2 + Cl2 + 2H2O 0,5 b) Vì axit flohidric ăn mòn các đồ vật bằng thủy tinh PTHH: SiO2 + 4HF SiF4 + ... ng hiệu suất của phản ứng đạt được 100%. - Số mol MnO2 = 0,8 mol; Số mol Cl2 = 0,6 mol 0,25 - PTHH: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O - Nhận xét: MnO2 dư 0,25 - mol 0,25 gam 0,25 ĐỀ 2B Câu 1: (1 điểm) Viết công thức hóa học của các hợp chất: a) Nhôm iotua; b) Silic tetraflorua; c) Axit hipobromơ; d) Criolit; Câu 2: (1 điểm) Cho bảng số liệu về nhiệt độ nóng chảy của các halogen có trong tự nhiên như sau: Nhiệt độ nóng chảy (0C) 113,6 -101,0 -7,3 -219,6 Nguyên tố X Y Z T Xác định tên nguyên tố X, Y, Z, T. Câu 3: (1 điểm) a) Viết phương trình phản ứng dùng để điều chế nước Gia-ven trong phòng thí nghiệm và trong công nghiệp. b) Viết phương trình hóa học của phản ứng xảy ra khi cho iot tác dụng với nhôm (có mặt nước làm xúc tác) và đồng (II) oxit tác dụng với dung dịch axit clohidric. Câu 4: (1 điểm) Sẽ quan sát được hiện tượng gì khi ta thêm dần dần nước clo vào dung dịch kali iotua có chứa sẵn một ít hồ tinh bột? Dẫn ra phương trình hóa học của phản ứng xảy ra. Câu 5: (1 điểm) Viết các phương trình hóa học của phản ứng xảy ra (nếu có) giữa các cặp chất sau: a) KMnO4 + HCl (đặc) b) Br2 + H2O c) SiO2 + HCl d) CaF2 + H2SO4 (đặc) Câu 6: (1 điểm) So sánh tính oxi hóa của clo và brom. Viết phương trình hóa học chứng minh. Câu 7: (1 điểm) Cần dùng 250 ml dung dịch HBr aM để kết tủa hoàn toàn 170 gam dung dịch AgNO3 8,0%. Tìm giá trị a. Câu 8: (1 điểm) Cho 23,52 gam Fe tác dụng với Br2 dư trong điều kiện thích hợp thu được m gam muối FeBr3. Tìm giá trị m. Biết hiệu suất phản ứng đạt 80%. Câu 9: (1 điểm) Hòa tan hoàn toàn 6,16 gam hỗn hợp X gồm Zn và Al trong dung dịch HCl dư thu được 6,496 lít khí H2 (đktc). Tính khối lượng mỗi kim loại có trong hỗn hợp X. Câu 10: (1 điểm) Cho 69,6 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 13,44 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. (Cho nguyên tử khối của: H = 1; N = 14; O = 16; Al = 27; Cl = 35,5; Mn = 55; Fe = 56; Zn = 65; Br = 80; Ag = 108) ----------HẾT---------- HƯỚNG DẪN CHẤM ĐỀ 2B NỘI DUNG ĐIỂM Câu 1: Viết công thức hóa học của các hợp chất: a) Clorua vôi; b) khoáng cacnalit; c) Canxi florua; d) Axit hipoclorơ; a) CaOCl2; b) KCl.MgCl2.6H2O; c) CaF2; d) HClO; 0,25/chất Câu 2: Cho bảng số liệu về nhiệt độ sôi của các halogen có trong tự nhiên như sau: Nhiệt độ nóng chảy (0C) 59,2 -34,1 -188,1 185,5 Nguyên tố X Y Z T Xác định tên nguyên tố X, Y, Z, T. Nhận xét: Nhiệt độ nóng chảy của các halogen tăng dần khi đi từ flo đến iot, nên: X là Brom; Y là Clo; Z là Flo và T là Iot 0,25/tên Câu 3: a) Viết phương trình phản ứng dùng để điều chế nước Gia-ven trong phòng thí nghiệm và trong công nghiệp. b) Viết phương trình hóa học của phản ứng xảy ra khi cho iot tác dụng với nhôm (có mặt nước làm xúc tác) và đồng (II) oxit tác dụng với dung dịch axit clohidric. a) - Trong phòng thí nghiệm: Cl2 + 2NaOH NaCl + NaClO + H2O - Trong công nghiệp: Điện phân dung dịch muối ăn (nồng độ từ 15-20%) trong thùng điện phân không có màng ngăn 2NaCl + 2H2O 2NaOH + H2 + Cl2 Cl2 + 2NaOH NaCl + NaClO + H2O 0,25 0,25 b) 2Al + 3I2 2AlI3 CuO + 2HCl CuCl2 + H2O 0,25 0,25 Câu 4: Sẽ quan sát được hiện tượng gì khi ta thêm dần dần nước clo vào dung dịch kali iotua có chứa sẵn một ít hồ tinh bột? Dẫn ra phương trình hóa học của phản ứng xảy ra. - Xuất hiện dung dịch màu vàng nâu Cl2 + 2KI I2 + 2KCl 0,25 0,25 - Sau đó, dung dịch vàng nâu chuyển sang màu xanh do iot tác dụng với hồ tinh bột 0,25 - Màu xanh cũng dần dần biến mất do Cl2 + H2O HCl + HClO 0,25 Câu 5: Viết các phương trình hóa học của phản ứng xảy ra giữa các cặp chất sau (nếu có): a) KMnO4 + HCl (đặc) b) Br2 + H2O c) SiO2 + HCl d) CaF2 + H2SO4 (đặc) a) 2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 + 8H2O 0,25 b) Br2 + H2O HBr + HBrO 0,25 c) SiO2 + HCl : không xảy ra phản ứng 0,25 d) CaF2 + H2SO4 (đặc) 2HF + CaSO4 0,25 Câu 6: So sánh tính oxi hóa của clo và brom. Viết phương trình hóa học chứng minh. - Tính oxi hóa của Cl2 > Br2 0,5 - PTHH: Cl2 + 2NaBr Br2 + 2NaCl 0,5 Câu 7: Cần dùng 250 ml dung dịch HBr aM để kết tủa hoàn toàn 170 gam dung dịch AgNO3 8,0%. Tìm giá trị a. - Số mol AgNO3 mol 0,25 - PTHH: HBr + AgNO3 AgBr + HNO3 (mol) 0,08 0,08 0,5 (M) 0,25 Câu 8: Cho 23,52 gam Fe tác dụng với Br2 dư trong điều kiện thích hợp thu được m gam muối FeBr3. Tìm giá trị m. Biết hiệu suất phản ứng đạt 80%. - Số mol Fe = 0,42 mol 0,25 - Theo lý thuyết: mol 0,25 - Vì hiệu suất phản ứng chỉ đạt 80% nên thực tế mol 0,25 gam 0,25 Câu 9: Hòa tan hoàn toàn 6,16 gam hỗn hợp X gồm Zn và Al trong dung dịch HCl dư thu được 6,496 lít khí H2 (đktc). Tính khối lượng mỗi kim loại có trong hỗn hợp X. - Gọi a, b lần lượt là số mol của Zn và Al có trong hỗn hợp 65a + 27b = 6,16 (1) - PTHH: Zn + 2HCl ZnCl2 + H2 2Al + 6HCl 2AlCl3 + 3H2 - Từ 2 PTHH trên có: a + 1,5b = (2) 0,5 - Giải (1) và (2) được: a = 0,02 và b = 0,18 - Vậy mZn = 0,02.65 = 1,3 gam và mAl = 6,16 1,3 = 4,86 gam 0,5 Câu 10: Cho 104,4 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 24,64 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. - Số mol MnO2 = 1,2 mol; Số mol Cl2 = 1,1 mol 0,25 - PTHH: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O - Nhận xét: MnO2 dư 0,25 - mol 0,25 gam 0,25 3. ĐỀ 3: Kiểm tra lớp 10L-S, 10A-T (H1) Câu 1: (1 điểm) Cho bảng số liệu về nhiệt độ nóng chảy của các halogen có trong tự nhiên như sau: Nhiệt độ nóng chảy (0C) 113,6 -101,0 -7,3 -219,6 Nguyên tố X Y Z T Xác định tên nguyên tố X, Y, Z, T. Câu 2: (1 điểm) Cho dãy chất sau: (a) Fe2O3, KMnO4, Cu; (b) Fe, CuO, AgNO3 (dd); (c) CaCO3, H2SO4, Mg(OH)2; (d) AgNO3 (dd), MgCO3, BaSO4; - Chọn dãy gồm các chất đều tác dụng được với dung dịch HCl. - Viết các phương trình phản ứng xảy ra. Câu 3: (1 điểm) Viết phương trình phản ứng xảy ra giữa các cặp chất sau và ghi rõ điều kiện (nếu có): (a) SiO2 + dung dịch HF; (b) Al và I2; (c) Br2 + dung dịch NaI; (d) H2 và I2; Câu 4: (1 điểm) Tiến hành thí nghiệm sau: Cho vào ống nghiệm khô một ít tinh thể KMnO4, nhỏ tiếp vào ống nghiệm vài giọt dung dịch axit clohidric đậm đặc. Đậy ống nghiệm bằng nút cao su có đính một băng giấy màu ẩm. Nêu hiện tượng quan sát được và viết phương trình hóa học của các phản ứng xảy ra. Câu 5: (1 điểm) Trong phòng thí nghiệm có các hóa chất: NaCl, MnO2, NaOH và H2SO4 đặc, ta có thể điều chế được nước Gia-ven không? Viết phương trình hóa học của các phản ứng. Câu 6: (1 điểm) a) Để điều chế flo, người ta phải điện phân dung dịch KF trong hidro florua lỏng đã được loại bỏ hết nước. Vì sao phải tránh sự có mặt của nước? b) Iot bị lẫn tạp chất là NaI. Làm thế nào để loại bỏ tạp chất đó. Câu 7: (1 điểm) Cần dùng 250 ml dung dịch NaBr aM để kết tủa hoàn toàn 170 gam dung dịch AgNO3 8,0%. Tìm giá trị a. Câu 8: (1 điểm) Cho 89,6 gam Fe tác dụng với Cl2 dư trong điều kiện thích hợp thu được m gam muối FeCl3. Tìm giá trị m. Biết hiệu suất phản ứng đạt 85%. Câu 9: (1 điểm) Hòa tan hoàn toàn 5,34 gam hỗn hợp X gồm Mg và Al trong dung dịch HCl dư thu được 6,496 lít khí H2 (đktc). Tính khối lượng mỗi kim loại có trong hỗn hợp X. Câu 10: (1 điểm) Cho 69,6 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 13,44 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. (Cho nguyên tử khối của: H = 1; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; Cl = 35,5; Mn = 55; Fe = 56; Br = 80; Ag = 108) ----------HẾT---------- HƯỚNG DẪN CHẤM ĐỀ 3 NỘI DUNG ĐIỂM Câu 1: Cho bảng số liệu về nhiệt độ sôi của các halogen có trong tự nhiên như sau: Nhiệt độ nóng chảy (0C) 59,2 -34,1 -188,1 185,5 Nguyên tố X Y Z T Xác định tên nguyên tố X, Y, Z, T. Nhận xét: Nhiệt độ nóng chảy của các halogen tăng dần khi đi từ flo đến iot, nên: X là Brom; Y là Clo; Z là Flo và T là Iot 0,25/tên Câu 2: Cho dãy chất sau: (a) Fe2O3, KMnO4, Cu; (b) Fe, CuO, AgNO3 (dd); (c) CaCO3, H2SO4, Mg(OH)2; (d) AgNO3 (dd), MgCO3, BaSO4; - Chọn dãy gồm các chất đều tác dụng được với dung dịch HCl. - Viết các phương trình phản ứng xảy ra. - Dãy (b) 0,25 - Các PTHH: Fe + 2HCl FeCl2 + H2 0,25 CuO + 2HCl CuCl2 + H2O 0,25 AgNO3 + HCl AgCl + HNO3 0,25 Câu 3: Viết phương trình phản ứng xảy ra giữa các cặp chất sau và ghi rõ điều kiện (nếu có): (a) SiO2 + dung dịch HF; (b) Al và I2; (c) Br2 + dung dịch NaI; (d) H2 và I2; (a) SiO2 + 4HF SiF4 + 2H2O 0,25 (b) 2Al + 3I2 2AlI3 0,25 (c) Br2 + 2NaI I2 + 2NaBr 0,25 (d) H2 + I2 2HI 0,25 Câu 4: Tiến hành thí nghiệm sau: Cho vào ống nghiệm khô một ít tinh thể KMnO4, nhỏ tiếp vào ống nghiệm vài giọt dung dịch axit clohidric đậm đặc. Đậy ống nghiệm bằng nút cao su có đính một băng giấy màu ẩm. Nêu hiện tượng quan sát được và viết phương trình hóa học của các phản ứng xảy ra. - Hiện tượng: + sủi bọt khí có màu vàng lục + giấy màu bị mất màu 0,5 - PTHH: 2KMnO4 + 16HCl 2KCl + 5Cl2 + 2MnCl2 + 8H2O Cl2 + H2O HCl + HClO 0,5 Câu 5: Trong phòng thí nghiệm có các hóa chất: NaCl, MnO2, NaOH và H2SO4 đặc, ta có thể điều chế được nước Gia-ven không? Viết phương trình hóa học của các phản ứng. - Ta có thể điều chế được nước Gia-ven 0,25 2NaCl + H2SO4 Na2SO4 + 2HCl 0,25 MnO2 + 4HCl MnCl2 + Cl2 + 2H2O 0,25 Cl2 + 2NaOH NaCl + NaClO + H2O 0,25 Câu 6: a) Để điều chế flo, người ta phải điện phân dung dịch KF trong hidro florua lỏng đã được loại bỏ hết nước. Vì sao phải tránh sự có mặt của nước? b) Iot bị lẫn tạp chất là NaI. Làm thế nào để loại bỏ tạp chất đó. a) Vì flo phân hủy mãnh liệt H2O ở ngay nhiệt độ thường 2F2 + 2H2O 4HF + O2 0,5 b) Đun nóng hỗn hợp iot và NaI thì chỉ có iot thăng hoa, ngưng tụ hơi iot ta được iot rắn tinh khiết. 0,5 Câu 7: (1 điểm) Cần dùng 250 ml dung dịch NaBr aM để kết tủa hoàn toàn 170 gam dung dịch AgNO3 8,0%. Tìm giá trị a. - Số mol AgNO3 mol 0,25 - PTHH: NaBr + AgNO3 AgBr + NaNO3 (mol) 0,08 0,08 0,5 (M) 0,25 Câu 8: (1 điểm) Cho 89,6 gam Fe tác dụng với Cl2 dư trong điều kiện thích hợp thu được m gam muối FeCl3. Tìm giá trị m. Biết hiệu suất phản ứng đạt 85%. - Số mol Fe = 1,6 mol 0,25 - Theo lý thuyết: mol 0,25 - Vì hiệu suất phản ứng chỉ đạt 85% nên thực tế mol 0,25 gam 0,25 Câu 9: Hòa tan hoàn toàn 5,34 gam hỗn hợp X gồm Mg và Al trong dung dịch HCl dư thu được 6,496 lít khí H2 (đktc). Tính khối lượng mỗi kim loại có trong hỗn hợp X. - Gọi a, b lần lượt là số mol của Mg và Al có trong hỗn hợp 24a + 27b = 5,34 (1) - PTHH: Mg + 2HCl MgCl2 + H2 2Al + 6HCl 2AlCl3 + 3H2 - Từ 2 PTHH trên có: a + 1,5b = (2) 0,5 - Giải (1) và (2) được: a = 0,02 và b = 0,18 - Vậy mMg = 0,02.24 = 0,48 gam và mAl = 5,34 0,48 = 4,86 gam 0,5 Câu 10: Cho 104,4 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 24,64 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. - Số mol MnO2 = 1,2 mol; Số mol Cl2 = 1,1 mol 0,25 - PTHH: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O - Nhận xét: MnO2 dư 0,25 - mol 0,25 gam 0,25
Tài liệu đính kèm:
 de_kiem_tra_1_tiet_lan_3_mon_hoa_hoc_10.doc
de_kiem_tra_1_tiet_lan_3_mon_hoa_hoc_10.doc





