Bài kiểm tra số 4 - Môn: Hóa học 10
Câu 1 : Cho hỗn hợp 2 muối MgCO3 và CaCO3 tan trong dung dịch HCl vừa đủ tạo ra 2,24 lít khí CO2 (đktc). Số mol của hỗn hợp 2 muối cacbonat ban đầu là:
A. 0,3 mol B. 0,2 mol C. 0,1 mol D. 0,15 mol
Câu 2 : Có 4 dung dịch: NaF, NaCl, NaBr, NaI đựng trong các lọ bị mất nhãn. Nếu dùng dung dịch AgNO3 thì có thể nhận biết được
A. 1 dung dịch B. 3 dung dịch C. 2 dung dịch D. 4 dung dịch
Câu 3 : Nguyên tố halogen chỉ có duy nhất số oxi hóa -1 trong các hợp chất là
A. Flo B. Brom C. Iot D. Clo
Câu 4 : Theo chiều tăng điện tích hạt nhân thì khả năng oxi hóa của các halogen theo thứ tự
A. không thay đổi B. giảm dần C. tăng dần D. tăng rồi giảm
Câu 5 : Clorua vôi là muối của canxi với 2 loại gốc axit là clorua Cl- và hipoclorit ClO-. Vậy clorua vôi được gọi là
A. muối axit B. muối trung hòa C. muối kép D. muối hỗn tạp
Câu 6 : Dãy chất nào sau đây đều tác dụng với dd HCl:
A. Cu, Al, NaOH B. Quỳ tím, Na, H2SO4
C. Mg, FeO, Ba(OH)2 D. Quỳ tím, Ag, AgNO3
Câu 7 : Để trung hòa lượng axit dư trong dịch vị dạ dày gây nên hiện tượng ợ chua, người ta sử dụng thuốc muối chứa
A. Na2CO3 B. NaCl C. NaOH D. NaHCO3
Câu 8 : Dãy axit nào sau đây được sắp xếp đúng theo thứ tự tính axit tăng dần?
A. HCl, HBr, HI, HF B. HI, HBr, HCl, HF
C. HF, HCl, HBr, HI D. HBr, HI, HF, HCl
Câu 9 : Chọn phương trình phản ứng đúng:
A. 2Fe + 6HCl → 2FeCl3 + 3H2 B. Fe + 2HCl → FeCl2 + H2
C. Fe + Cl2 → FeCl2 D. Cu + 2HCl → CuCl2 + H2
Câu 10 : Đặc điểm nào dưới đây không phải là đặc điểm chung của các halogen?
A. Tác dụng mạnh với nước. B. Có tính oxi hóa mạnh.
C. Lớp e ngoài cùng của nguyên tử có 7e. D. Tác dụng với hầu hết các kim loại.
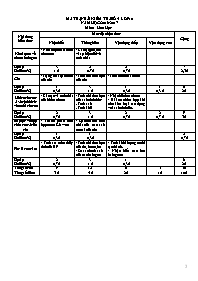
MA TRẬN BÀI KIỂM TRA SỐ 4 LỚP 10 NĂM HỌC: 2016-2017 Môn: Hóa Học Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Khái quát về nhóm halogen - Nêu được cấu hình electron - Cấu tạo phân tử và sự biến đổi về tính chất Số câu Số điểm(%) 3 1 đ 2 0.7 đ 2 0,7đ 7 2,3đ Clo - Trạng thái tự nhiên của clo - Tính chất hóa học của clo - Tính thể tích khí clo Số câu Số điểm(%) 1 0,3 đ 3 1 đ 1 0,3 đ 1 0,3 đ 6 2đ Hiđro clorua- Axit clohiđric và muối clorua - Cấu tạo và tính chất của hiđro clorua - Tính chất hóa học của axit clohđric: . Tính axit . Tính khử - Nhận biết ion clorua - Bài toán hỗn hợp khi cho kim loại tác dụng với axit clohđic. Số câu Số điểm(%) 2 0,7 đ 3 1 đ 2 0,7 đ 2 0,7 đ 9 3đ Sơ lược về hợp chất có oxi của clo - Thành phần hỗn hợp nước Gia-ven - Sự biến đổi tính chất của các axit có oxi của clo Số câu Số điểm(%) 1 0,3 đ 1 0,3 đ 2 0,7đ Flo- Brom- Iot - Tính ăn mòn thủy tinh của HF - Tính chất hóa học của flo, brom, iot - So sánh tính axit của các halogen - Tính khối lượng muối tạo thành. - Nhận biết các ion halogenua Số câu Số điểm(%) 2 0,7 đ 3 1 đ 1 0,3 đ 6 2đ Tổng số câu Tổng số điểm 9 3 đ 12 4 đ 6 2đ 3 1 đ 30 10đ SỞ GD-ĐT NINH THUẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 4) - LỚP 10 TRƯỜNG THPT BÁC ÁI NĂM HỌC 2016-2017 Môn: Hóa học – Chương trình chuẩn Mã đề: 123 Thời gian làm bài: 45 phút (Không kể thời gian phát đề) Đề ra: (Đề kiểm tra có 02 trang) (Cho biết khối lượng nguyên tử của: Ca=40; Al=27; Mg=24; Fe=56; Ag=108; Cl=35,5; F=19; Na=23) Câu 1 : Cho hỗn hợp 2 muối MgCO3 và CaCO3 tan trong dung dịch HCl vừa đủ tạo ra 2,24 lít khí CO2 (đktc). Số mol của hỗn hợp 2 muối cacbonat ban đầu là: A. 0,3 mol B. 0,2 mol C. 0,1 mol D. 0,15 mol Câu 2 : Có 4 dung dịch: NaF, NaCl, NaBr, NaI đựng trong các lọ bị mất nhãn. Nếu dùng dung dịch AgNO3 thì có thể nhận biết được A. 1 dung dịch B. 3 dung dịch C. 2 dung dịch D. 4 dung dịch Câu 3 : Nguyên tố halogen chỉ có duy nhất số oxi hóa -1 trong các hợp chất là A. Flo B. Brom C. Iot D. Clo Câu 4 : Theo chiều tăng điện tích hạt nhân thì khả năng oxi hóa của các halogen theo thứ tự A. không thay đổi B. giảm dần C. tăng dần D. tăng rồi giảm Câu 5 : Clorua vôi là muối của canxi với 2 loại gốc axit là clorua Cl- và hipoclorit ClO-. Vậy clorua vôi được gọi là A. muối axit B. muối trung hòa C. muối kép D. muối hỗn tạp Câu 6 : Dãy chất nào sau đây đều tác dụng với dd HCl: A. Cu, Al, NaOH B. Quỳ tím, Na, H2SO4 C. Mg, FeO, Ba(OH)2 D. Quỳ tím, Ag, AgNO3 Câu 7 : Để trung hòa lượng axit dư trong dịch vị dạ dày gây nên hiện tượng ợ chua, người ta sử dụng thuốc muối chứa A. Na2CO3 B. NaCl C. NaOH D. NaHCO3 Câu 8 : Dãy axit nào sau đây được sắp xếp đúng theo thứ tự tính axit tăng dần? A. HCl, HBr, HI, HF B. HI, HBr, HCl, HF C. HF, HCl, HBr, HI D. HBr, HI, HF, HCl Câu 9 : Chọn phương trình phản ứng đúng: A. 2Fe + 6HCl → 2FeCl3 + 3H2 B. Fe + 2HCl → FeCl2 + H2 C. Fe + Cl2 → FeCl2 D. Cu + 2HCl → CuCl2 + H2 Câu 10 : Đặc điểm nào dưới đây không phải là đặc điểm chung của các halogen? A. Tác dụng mạnh với nước. B. Có tính oxi hóa mạnh. C. Lớp e ngoài cùng của nguyên tử có 7e. D. Tác dụng với hầu hết các kim loại. Câu 11 : Số oxi hóa của brom trong các hợp chất HBr, HBrO, KBrO3, BrF3 lần lượt là: A. -1, +1, +1, -3 B. -1, +1, +5, +3. C. -1, +1, +5, -3. D. -1, +1, +2, +3. Câu 12 : Bình thủy tinh có thể chứa các dung dịch axit trong dãy nào sau đây ? A. HCl, H2SO4, HF, HNO3 B. HCl, H2SO4, HF C. H2SO4, HF, HNO3 D. HCl, H2SO4, HNO3 Câu 13 : Hòa tan 0,6 gam một kim loại có hóa trị II vào một lượng dd HCl dư. Sau phản ứng thu được 0,336 lít khí H2 (đktc). Kim loại đó là A. Al B. Mg C. Fe D. Ca Câu 14 : Cho lượng dư dung dịch AgNO3 tác dụng với hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là A. 14,35 g B. 10,8 g C. 21,6 g D. 27,05 g Câu 15 : Nước Gia-ven là hỗn hợp của dãy chất: A. CaOCl2, H2O B. HCl, HClO, H2O C. NaCl, NaClO, H2O D. NaCl, NaClO4, H2O Câu 16 : Chất chỉ có tính oxi hoá, không có tính khử là A. F2 B. Br2 C. Cl2 D. I2 Câu 17 : Kim loại khi tác dụng với HCl và Clo cho cùng một muối clorua kim loại là A. Cu B. Ag C. Mg D. Fe Câu 18 : Khi mở vòi nước máy, nếu chú ý một chút sẽ phát hiện mùi lạ. Đó là do nước máy còn lưu giữ vết tích của thuốc sát trùng chính là clo và người ta giải thích khả năng diệt khuẩn là do A. clo tác dụng với nước tạo ra kháng thể diệt khuẩn. B. clo có thể phát ra tia cực tím. C. clo độc nên có tính sát trùng. D. clo tác dụng với nước tạo ra HClO chất này có tính oxi hóa mạnh. Câu 19 : Cặp chất nào sau đây không phản ứng? A. I2 + H2O B. NaOH + HCl C. Cl2 + KBr D. SiO2 + HF Câu 20 : Cấu hình e lớp ngoài cùng của nguyên tử các nguyên tố halogen là A. ns2 np5 B. ns2 np4 C. ns2 np6 D. ns2 np3 Câu 21 : Các halogen có tính chất hóa học cơ bản giống nhau vì A. có cùng số oxi hóa trong các hợp chất B. có cấu hình e lớp ngoài cùng giống nhau C. đều là những nguyên tố phi kim D. trong phân tử X2 (F2, Cl2, Br2, I2) là liên kết cộng hóa trị Câu 22 : Axit clohidric có thể tham gia phản ứng oxi hóa - khử với vai trò là A. chất oxi hóa B. chất khử C. môi trường D. chất xúc tác Câu 23 : Hòa tan hoàn toàn 7,8 gam hỗn hợp Mg và Al bằng dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7,0 gam so với ban đầu. Số mol axit HCl tham gia phản ứng là A. 0,04 mol B. 0,8 mol C. 0,4 mol D. 0,08 mol Câu 24 : Để nhận biết 4 lọ mất nhãn đựng HCl, KOH, NaNO3, NaCl, thuốc thử cần dùng là: A. NaOH B. Quỳ tím C. AgNO3 D. Quỳ tím; AgNO3 Câu 25 : Để tẩy uế trong bệnh viện người ta thường dùng A. tia phóng xạ B. clorua vôi C. nước Gia–ven D. khí ozon Câu 26 : Cho phản ứng: SO2 + Cl2 + 2H2O 2HCl + H2SO4 Vai trò của Clo là A. chất oxi hóa B. chất khử C. vừa là chất oxi hóa, vừa là chất khử D. chất xúc tác Câu 27 : Chất nào dưới đây có hiện tượng thăng hoa khi đun nóng (trạng thái rắn chuyển sang trạng thái hơi, không qua trạng thái lỏng): A. Cl2 B. I2 C. Br2 D. F2 Câu 28 : Chất có thể làm giấy quỳ tím ẩm hóa đỏ là A. khí amoniac B. khí hiđroclorua C. khí hiđro D. dung dịch NaOH Câu 29 : Cho một mẫu Na tác dụng vừa đủ với 4,48l khí Cl 2 (đktc). Khối lượng muối thu được là A. 14,35g B. 11,7g C. 23,4g D. 5,85g Câu 30 : Thuốc thử để nhận biết I2 là A. hồ tinh bột B. quỳ tím C. Na D. dd AgNO3 --- Hết --- Họ và tên: Lớp: BẢNG ĐÁP ÁN ĐỀ 123 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 SỞ GD – ĐT NINH THUẬN TRƯỜNG THPT BÁC ÁI Đề chính thức ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 4) – LỚP 10 NĂM HỌC 2016 – 2017 Môn: Hóa học – Chương trình chuẩn Thời gian làm bài: 45 phút (Không kể thời gian phát đề) BẢNG ĐÁP ÁN ĐỀ 123 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 C D A C D C D C B A B D D A C 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 A C D A A B B B D B A B B C A
Tài liệu đính kèm:
 bai_kiem_tra_so_4_mon_hoa_hoc_10.doc
bai_kiem_tra_so_4_mon_hoa_hoc_10.doc





