Bài kiểm tra số 3 - Lớp 10 môn: Hóa Học
Câu 1: Chất nào sau đây được dùng để tẩy màu, sát trùng ?
A. CaOCl2 B. KClO3 C. NaCl D. N2
Câu 2: Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là:
A. ns2np3. B. ns2np4. C. ns2np5. D. ns2np6.
Câu 3: Cho 31,6g KMnO4 tác dụng với HCl đậm đặc sinh ra V lít khí clo (đktc). V có giá trị là:
A. 4,48 lít B. 2,24 lit C. 8,96 lít D. 11,2 lít
Câu 4: Cho phản ứng: 2NaOH + Cl2 NaCl + NaClO + H2O. Trong phản ứng này, clo đóng vai trò:
A. Vừa là chất oxi hóa, vừa là chất khử B. Chất oxi hóa
C. Môi trường D. Chất khử
Câu 5: Nước Gia-ven là hỗn hợp gồm những chất nào sau đây ?
A. NaCl, NaClO, H2O B. HCl, HClO, H2O C. NaCl, NaClO3, H2O D. NaCl, NaClO4, H2O
Câu 6: Phản ứng nào sau đây chứng tỏ brom có tính oxi hóa mạnh hơn iot?
A. Br2 + 2KIO3 I2 + 2KBrO3 B. I2 + 2NaBr 2NaI + Br2
C. 3I2 + 3H2O 5HI + HIO3 D. Br2 + 2KI 2KBr + I2
Câu 7: Cho dung dịch chứa 24,9g KI phản ứng với lượng dư dung dịch AgNO3. Khối lượng kết tủa thu được là:
A. 25,35g B. 35,25g C. 55,32g D. 32,55g
Câu 8: Có 4 dung dịch NaCl, NaBr, KI, K2SO4 đựng trong các lọ bị mất nhãn. Để nhận biết các dung dịch này có thể chọn thuốc thử nào sau đây?
A. dung dịch AgNO3. B. dung dịch BaCl2, dung dịch AgNO3.
C. Quỳ tím. D. dung dịch NaOH.
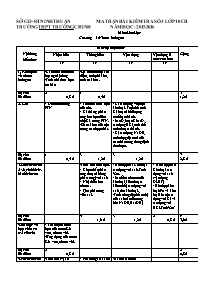
SỞ GD-ĐT NINH THUẬN MA TRẬN BÀI KIỂM TRA SỐ 3 LỚP 10CB TRƯỜNG THPT TRƯỜNG CHINH NĂM HỌC:2015-2016 Môn:HóaHọc Chương 5:Nhóm halogen Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TN TN TN 1. Khái quát về nhóm halogen -Cấu hình electron lớp ngoài cùng -Tính chất hoá học cơ bản -Sự biến đổi độ âm điện, tính phi kim, tính oxi hóa. Số câu Số điểm 2 0,8 đ 1 0,4 đ 3 1,2đ 2. Clo - Điều chế trong PTN - Tính chất hoá học của clo. - Cân bằng phản ứng hoá học điều chế Cl2 trong PTN. -Số oxi hoá của clo trong các hợp chất. - Cl2 tác dụng với một kim loại. Tính thể tích Cl2 hoặc khối lượng muối tạo thành. - MnO2, hoặc KMnO4 tác dụng HCl, tính thể tích clo tạo thành. - Cl2 tác dụng NaOH, tính nồng độ mol của các chất trong dung dịch thu được. Số câu Số điểm 1 0,4 đ 3 1,2 đ 3 1,2đ 7 2,8 đ 3.Hidroclorua.Axit clohidric. Muối clorua -Tính chất hoá học. - Chọn chất phản ứng (hoặc không phản ứng) với axit - Nhận biết ion clorua. - Tìm phản ứng viết sai. - Hỗn hợp hai Kim loại tác dụng vơi axit. Tính %m. - Muối cacbonat (của kim loại kiềm hoặc kiềm thổ) tác dụng với axit, tìm kim loại. -Tính nồng độ (thể tích) của axit cần để trung hòa NaOH, Ba(OH)2 - Hỗn hợp các Kim loại tác dụng vơi axit (vận dụng ĐLBT) - Hỗn hợp kim loại (Fe và kim loại khác) tác dụng với Cl2 và tác dụng với HCl. Tính %m? Số câu Số điểm 4 1,6 đ 3 1,2 đ 2 0,8 đ 9 3,6đ 4.Sơ lược về hợp chất có oxi của clo - Thành phần hóa học của nước Gia ven, clorua vôi. -Ứng dụng của nước Gia ven, clorua vôi. Số câu Số điểm 2 0,8 đ 2 0,8đ 5.Flo-brom-iot -Tính chất vật lí - Phản ứng so sánh tính oxi hoá -Phản ứng của các ion halogenua với dung dịch AgNO3 -Bài toán muối halogenua tác dụng AgNO3, tính lượng kết tủa. Số câu Số điểm 1 0,4 đ 2 0,8 đ 1 0,4 đ 4 1,6đ Tổng số câu Tổng số điểm 6 2,4 đ 10 4,0đ 7 2.8đ 2 0,8 đ 25 10đ Họ và tên:..................................................................... .........................................Lớp: ................................. TRƯỜNG THPT TRƯỜNG CHINH TỔ: HÓA – SINH – KTNN ĐỀ 132 ĐỀ KIỂM TRA 1 TIẾT LẦN 3 Môn: Hóa Học 10CB Năm học 2015 – 2016 Cho: Li=7; Na=23; K=39; Rb=85,5; Fe=56; Mg=24; Al=27; Ba=137 Cl=35,5; O=16; H=1; Mn=55; Ag=108; Zn=65;I=127 Câu 1: Chất nào sau đây được dùng để tẩy màu, sát trùng ? A. CaOCl2 B. KClO3 C. NaCl D. N2 Câu 2: Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là: A. ns2np3. B. ns2np4. C. ns2np5. D. ns2np6. Câu 3: Cho 31,6g KMnO4 tác dụng với HCl đậm đặc sinh ra V lít khí clo (đktc). V có giá trị là: A. 4,48 lít B. 2,24 lit C. 8,96 lít D. 11,2 lít Câu 4: Cho phản ứng: 2NaOH + Cl2 NaCl + NaClO + H2O. Trong phản ứng này, clo đóng vai trò: A. Vừa là chất oxi hóa, vừa là chất khử B. Chất oxi hóa C. Môi trường D. Chất khử Câu 5: Nước Gia-ven là hỗn hợp gồm những chất nào sau đây ? A. NaCl, NaClO, H2O B. HCl, HClO, H2O C. NaCl, NaClO3, H2O D. NaCl, NaClO4, H2O Câu 6: Phản ứng nào sau đây chứng tỏ brom có tính oxi hóa mạnh hơn iot? A. Br2 + 2KIO3 I2 + 2KBrO3 B. I2 + 2NaBr 2NaI + Br2 C. 3I2 + 3H2O 5HI + HIO3 D. Br2 + 2KI 2KBr + I2 Câu 7: Cho dung dịch chứa 24,9g KI phản ứng với lượng dư dung dịch AgNO3. Khối lượng kết tủa thu được là: A. 25,35g B. 35,25g C. 55,32g D. 32,55g Câu 8: Có 4 dung dịch NaCl, NaBr, KI, K2SO4 đựng trong các lọ bị mất nhãn. Để nhận biết các dung dịch này có thể chọn thuốc thử nào sau đây? A. dung dịch AgNO3. B. dung dịch BaCl2, dung dịch AgNO3. C. Quỳ tím. D. dung dịch NaOH. Câu 9: Sục 6,72 lít khí Cl2 (đktc) vào 500ml dung dịch NaOH 2M, đun nóng (phản ứng tạo muối clorat). Nồng độ mol của NaCl trong dung dịch sau phản ứng là: A. 0,8M B. 1M C. 0,6M D. 1,2M Câu 10: Trong nhóm Halogen, từ flo đến iot điều khẳng định nào sau đây đúng? A. Tính phi kim tăng dần B. Các tính chất không thay đổi C. Tính oxi hóa mạnh dần D. Độ âm điện giảm dần Câu 11: Phát biểu nào sau đây không đúng? A. Brom dễ bay hơi, hơi brom độc B. Brom, iot đều dễ tan trong nước C. Flo là chất khí, màu lục nhạt, rất độc D. Khi đun nóng, iot bị thăng hoa Câu 12: Chọn phương trình phản ứng sai: A. Fe +2HCl FeCl2 + H2 B. Fe(OH)3 +3HCl FeCl3 +3H2O C. Cu +2HCl CuCl2 + H2 D. MnO2 + 4HCl MnCl2 + Cl2 + 2H2O Câu 13: Cho 3,36 lít khí clo (đktc) tác dụng vừa đủ với kim loại sắt. Khối lượng muối clorua thu được là: A. 15,06g B. 16,25g C. 19,05g D. 16,52g Câu 14: Dãy gồm các kim loại đều phản ứng được với dung dịch HCl là: A. Fe, Ca, Hg B. Ca, Mg, Ag C. Ca, Al, Fe D. Mg, Fe, Cu Câu 15: Hòa tan hoàn toàn 20,7g một muối cacbonat của kim loại kiềm bằng dung dịch HCl dư thu được 3,36 lít khí (đktc). Kim loại đã cho là: A. Li B. Na C. K D. Rb Câu 16: Tính chất hóa học chung của các Halogen là: A. Tác dụng với nước B. Tính oxi hóa và tính khử C. Tính khử D. Tính oxi hóa mạnh Câu 17: Phản ứng nào sau đây được dùng để điều chế khí Clo trong phòng thí nghiệm? A. MnO2 + 4HCl MnCl2 + Cl2 + 2H2O B. NaClO + 2HCl NaCl + Cl2 + H2O C. 2HClH2 + Cl2 D. 2NaCl + 2H2O 2NaOH + Cl2 + H2 Câu 18: Số oxi hóa của clo trong các chất: HCl, KClO3, NaClO, HClO2, HClO4 là: A. +1, +5, -1, +3, +7 B. -1, -5, -1, -3, -7 C. -1, +5, +1, -3, -7 D. -1, +5, +1, +3, +7 Câu 19: Cho phản ứng: KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O. Tổng hệ số của các chất trong phương trình phản ứng là: A. 25 B. 35 C. 40 D. 30 Câu 20: Axit clohiđric có những tính chất: 1. Làm quỳ tím hóa đỏ 2. Làm đổi màu phenolphtalein. 3. Phản ứng với nhiều kim loại 4. Hòa tan đồng. 5. Trung hòa canxi hiđroxit 6. Hòa tan sắt (III) oxit 7. Tác dụng với tất cả các muối. Trong những tính chất trên có bao nhiêu tính chất đúng? A. 7 B. 4 C. 6 D. 5 Câu 21: Cho 20 gam hỗn hợp Al, Fe, Zn vào dung dịch HCl vừa đủ, người ta thu được 8,96 lít hiđro (ở đktc). Tính khối lượng muối khan thu được. A. 30,4 gam B. 19,6 gam C. 48,4 gam D. 52,3 gam Câu 22: Cho hỗn hợp A gồm Fe và Mg vào dung dịch HCl vừa đủ thì thu được 4,48 lít hiđro (đktc). Mặt khác A tác dụng vừa đủ với 5,6 lít clo (đktc). Thành phần trăm theo khối lượng của Fe trong A là: A. 70%. B. 57%. C. 30%. D. 43%. Câu 23: Lần lượt nhỏ vài giọt dung dịch AgNO3 vào các dung dịch: NaCl, KI, KBr, NaF. Số kết tủa thu được là: A. 1 B. 2 C. 3 D. 4 Câu 24: Hòa tan hoàn toàn 10,2g hỗn hợp gồm Mg và Al bằng dung dịch HCl dư thu được 11,2 lít khí H2 (đktc). Thành phần trăm theo khối lượng của Mg trong hỗn hợp là: A. 52,94% B. 47,06% C. 46,07% D. 25,94% Câu 25: Để trung hòa dung dịch chứa 51,3g Ba(OH)2 cần dùng thể tích dung dịch HCl 1M là: A. 600ml B. 900ml C. 400ml D. 500ml ----------------------------------------------- ----------- HẾT ---------- ĐÁP ÁN KIỂM TRA 1 TIẾT LẦN 3 LỚP 10 CB Năm học: 2015-2016 ĐỀ 132 ĐỀ 209 ĐỀ 357 ĐỀ 485 ĐỀ 570 ĐỀ 628 1A 1A 1C 1A 1B 1A 2C 2D 2A 2A 2B 2D 3D 3B 3B 3D 3D 3A 4A 4A 4C 4D 4B 4A 5A 5C 5D 5A 5D 5C 6D 6B 6D 6B 6A 6B 7B 7A 7B 7C 7D 7A 8B 8B 8B 8B 8A 8B 9B 9B 9D 9D 9A 9C 10D 10D 10D 10D 10D 10C 11B 11C 11C 11C 11C 11B 12C 12D 12A 12C 12C 12B 13B 13A 13C 13D 13B 13D 14C 14C 14A 14B 14A 14D 15C 15C 15A 15C 15C 15D 16D 16C 16C 16D 16D 16A 17A 17D 17D 17A 17C 17D 18D 18B 18A 18C 18B 18B 19B 19B 19A 19B 19D 19C 20B 20A 20C 20B 20B 20D 21C 21C 21D 21C 21D 21D 22A 22C 22B 22A 22A 22C 23C 23B 23D 23D 23B 23C 24B 24A 24B 24B 24C 24B 25A 25D 25A 25D 25C 25B
Tài liệu đính kèm:
 bai_kiem_tra_so_3_lop_10_mon_hoa_hoc.doc
bai_kiem_tra_so_3_lop_10_mon_hoa_hoc.doc





