Bài kiểm tra số 2 - Môn Hóa khối 10
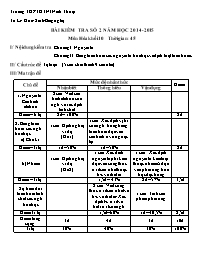
I/ Nội dung kiểm tra: Chương I: Nguyên tử
Chương II: Bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn.
II/ Cấu trúc đề: Tự luận : (5 câu chia thành 9 câu nhỏ)
III/ Ma trận đề:
Chủ đề Mức độ nhân thức Điểm
Nhận biết Thông hiểu Vận dụng
1. Nguyên tử: Cấu hình eletron 2 câu: Viết cấu hình eletron của ngtử và xác định tính chất
Điểm – tỉ lệ 2đ – 100% 2đ
2. Bảng tuần hoàn các ngtố hóa học
a) Chu kì 1 câu: Định nghĩa, ví dụ
(Đề 1) 1 câu: Xác định vị trí của ngtố trong bảng tuần hoàn dựa vào cấu hình e và ngược lại
Điểm –Tỉ lệ 1đ – 50% 1đ – 50% 2đ
b) Nhóm 1 câu: Định nghĩa, ví dụ
(Đề 2) 1 câu: Xác đinh nguyên tố phi kim dựa vào công thức oxit cao nhất hoặc h/c với hidro 1 câu: Xác định nguyên tố kim loại thuộc nhóm A dựa vàò phản ứng hóa học đặc trưng
Trường THPT DTNT Ninh Thuận Tổ Lí- Hóa-Sinh-Công nghệ BÀI KIỂM TRA SỐ 2 NĂM HỌC 2014-2015 Môn Hóa khối 10 Thời gian: 45 ’ I/ Nội dung kiểm tra: Chương I: Nguyên tử Chương II: Bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn. II/ Cấu trúc đề: Tự luận : (5 câu chia thành 9 câu nhỏ) III/ Ma trận đề: Chủ đề Mức độ nhân thức Điểm Nhận biết Thông hiểu Vận dụng 1. Nguyên tử: Cấu hình eletron 2 câu: Viết cấu hình eletron của ngtử và xác định tính chất Điểm – tỉ lệ 2đ – 100% 2đ 2. Bảng tuần hoàn các ngtố hóa học a) Chu kì 1 câu: Định nghĩa, ví dụ (Đề 1) 1 câu: Xác định vị trí của ngtố trong bảng tuần hoàn dựa vào cấu hình e và ngược lại Điểm –Tỉ lệ 1đ – 50% 1đ – 50% 2đ b) Nhóm 1 câu: Định nghĩa, ví dụ (Đề 2) 1 câu: Xác đinh nguyên tố phi kim dựa vào công thức oxit cao nhất hoặc h/c với hidro 1 câu: Xác định nguyên tố kim loại thuộc nhóm A dựa vàò phản ứng hóa học đặc trưng Điểm – Tỉ lệ 1,5đ – 43% 2đ – 57% 3,5đ Sự biến đổi tuần hoàn tính chất các ngto hóa học 2 câu: Viết công thức oxit cao nhất và h/c với hidro- Xác định t/c oxit và hidroxit của ngtố 1 câu: Tính sản phẩm phản ứng Điểm Tỉ lệ 1,5đ– 60% 1đ – 40,5% 2,5đ Điểm tổng cộng 3đ 4đ 3đ 10đ Tỉ lệ 30% 40% 30% 100% ĐỀ VÀ ĐÁP ÁN BÀI KIỂM TRA 1 TIẾT MÔN HÓA LỚP 10 ( BÀI SỐ 1) ĐỀ 1 Câu 1(1,5đ): Chu kì là gì? Cho ví dụ? Cho 12X hãy xác định chu kì của X? Câu 2: R ở chu kì 4, nhóm IIIA. Viết cấu hình eletron và xác định tính chất của R? Câu 3: Cho 17X : a) Viết cấu hình eletron của và xác định tính chất của X b) Xác định vị trí của X trong bảng tuần hoàn c) Viết công thức oxit cao nhất và hợp chất với hidro(nếu có) của X d) Oxit cao nhất và hidroxit của X có tính chất gi? Câu 4: Hòa tan hoàn toàn 9,75g một kim loại kiềm A vào 90,5g nước thu được 2,8 lit khí H2 (đktc) và dd X. a) Xác định kim loại A b) Tính nồng độ phần trăm của dd X ( Kim loại kiềm: Li = 7; Na = 23; K =39; Rb = 85 và H = 1; O = 16) Câu 5: Oxit cao nhất của nguyên tố có dạng R2O5, hợp chất khí với hidro của nó chứa 91,18% R. Xác định R. ( biết: O = 16; H = 1; N = 14; P = 31; S = 32; Cl = 35,5; Br = 80; C = 12; Si = 28) ĐỀ2 Câu 1: Nhóm nguyên tố là gì? Cho ví dụ 1 nhóm nguyên tố nhóm A? Cho 12X cho biết X ở nhóm nào? (1,5đ) Câu 2: R ở chu kì 4, nhóm VA. Viết cấu hình eletron và xác định tính chất của R Câu 3: Cho 12X: a) Viết cấu hình eletron của và xác định tính chất của X b) Xác định vị trí của X trong bảng tuần hoàn c) Viết công thức oxit cao nhất và hợp chất với hidro(nếu có) của X d) Oxit cao nhất và hidroxit của X có tính chất gi? Câu 4: Hòa tan hoàn toàn 27,4g kim loại A (nhóm IIA) vào 173g nước thu được dd X và 4,48 lit khí H2 (đktc) a) Xác định kim loại A b) Tính nồng độ phần trăm của dung dịch X ( Kim loại nhóm IIA: Be = 9; Mg = 24; Ca = 40; Sr = 88; Ba = 137 và H = 1; O = 16; C = 12 ) Câu 5: Hợp chất khí với hidro của một nguyên tố có dạng RH4, oxit cao nhát của nó chứa 72,73% Oxi. Xác định R ( Biết O = 16; S = 32; C =12; P = 31; Cl = 35,5; Si = 28; N = 14; H = 1; Br = 80) Đáp án đề số 1: Câu Lời giải tóm tắt Biểu điểm Câu 1 Chu kì là dãy các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân và có cùng số lớp eletron. Ví dụ: chu kì 3 gồm: Na, Mg, Al, Si, P, S, Cl (có 3 lớp eletron) 1đ 0,5đ 0,5đ Câu 2 R có 4 lớp e, có 3e lớp ngoài cùng => R: 1s22s22p63s23p63d104s24p1 R là kim loại (vì có 3e lớp ngoài cùng) 1đ 0,5đ 0,5đ Câu 3 a) 17X: 1s22s22p63s23p5 . X là phi kim (Có 7e lớp ngoài cùng) b) X có Z = 17, 3 lớp eletron, 7e lớp ngoài cùng (nguyên tố p) nên X có số thứ tự 17, chu kì 3, nhóm VIIA c) X(nhómVIIA) công thức oxit cao nhất: X2O7, hợp chất với H: HX. d) Oxit X2O7 và hidroxit HXO4 có tính chất axit (vì X là phi kim) 3,5đ 1đ 1đ 0,5đ 1đ Câu 4 a) Số mol H2 = 0,125mol. Phương trình phản ứng: A + H2O à AOH + 1/2H2 Theo phương trình phản ứng: số mol A = 2 lần số mol H2 = 0,25mol MA = 9,75 : 0,25 = 39 nên A là K b) Khối lượng KOH = 0,25 x 56 = 14g Khối lượng dd KOH = 9,75 + 90,5 – 0,25 x 2 = 99,75g C% (KOH) = (14 x 100) : 99,75 = 14% 3đ (2đ) 0,25đ 0,5đ 0,5đ 0,75đ (1đ) 0,25đ 0,25đ 0,5đ Câu 5 Oxit cao nhất của R: R2O5 nên hợp chất với H của R là: RH3 chứa 91,18%R %R = (MR x 100) : (MR + 3) = 91,18 à MR = 31 nên R là P 1,5đ 0,5đ 1đ Đáp án đề số 2: Câu Lời giải tóm tắt Biểu điểm Câu 1 Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình eletron tương tự nhau nên tính chất hóa học giống nhau. Ví dụ: nhóm IA gồm: Li, Na, K, Rb, Cs, Fr (cùng có 1e lớp ngoài cùng) 1đ 0,5đ 0,5đ Câu 2 R có 4 lớp e, có 5e lớp ngoài cùng => R: 1s22s22p63s23p63d104s24p3 R là phi kim (vì có 5e lớp ngoài cùng) 1đ 0,5đ 0,5đ Câu 3 a) 12X: 1s22s22p63s2 . X là kim loại (Có 2e lớp ngoài cùng) b) X có Z = 12, 3 lớp eletron, 2e lớp ngoài cùng (nguyên tố s) nên X có số thứ tự 12, chu kì 3, nhóm IIA c) X ở nhóm IIA nên công thức oxit cao nhất: XO. d) Oxit XO và hidroxit X(OH)2 có tính chất bazo (vì X là kim loại) 3,5đ 1đ 1đ 0,5đ 1đ Câu 4 a) Số mol H2 = 0,2mol. Phương trình phản ứng: A + 2H2O à A(OH)2 + H2 Theo phương trình phản ứng: số mol A = số mol H2 = 0,2mol MA = 27,4 : 0,2 = 137 nên A là Ba b) Khối lượng Ba(OH)2 = 0,2 x 171 = 34,2g Khối lượng dd Ba(OH)2 = 27,4+ 173 – 0,2 x 2 = 200g C% ddBa(OH)2 = (34,2 x 100) : 200 = 17,1% 3đ (2đ) 0,25đ 0,5đ 0,5đ 0,75đ (1đ) 0,25đ 0,25đ 0,5đ Câu 5 Hợp chất với H của R: RH4 nên oxit cao nhất của R là: RO2 %O = (32 x 100) : (MR + 32) = 72,73 à MR = 12 nên R là C 1,5đ 0,5đ 1đ Lưu ý: Học sinh có thể giải bằng cách khác nếu đúng vẫn được điểm tối đa. Phan rang ngày 24 tháng 10 năm 2014 PHT TTCM GVBM Nguyễn Thị Thu Thủy Tài Nhất Chuyên Huỳnh Thị Thu Thủy – Hồ Thị Quý
Tài liệu đính kèm:
 bai_kiem_tra_so_2_mon_hoa_khoi_10.doc
bai_kiem_tra_so_2_mon_hoa_khoi_10.doc





