Kiểm tra học kì 2 - Môn Hóa học lớp 10
Câu 1: Chọn phát biểu không đúng.
A. Axit flohidric là axit có tính chất ăn mòn các đồ vật bằng thủy tinh.
B. Nước Gia-ven là dung dịch hỗn hợp muối NaCl và NaClO.
C. Ở điều kiện thường, iot là chất khí có màu đen tím.
D. Brom chỉ oxi hóa được hidro ở nhiệt độ cao tạo ra khí hidrobromua.
Câu 2: Chọn phản ứng dùng để điều chế Cl2 trong công nghiệp.
A. 2NaCl + 2H2O 2NaOH + H2 + Cl2.
B. MnO2 + 4HCl MnCl2 + Cl2 + 2H2O.
C. HClO3 + 5HCl 3Cl2 + 3H2O.
D. 2HNO3 + 2HCl 2NO2 + Cl2 + 2H2O.
Câu 3: Trong công nghiệp, phản ứng hóa học tạo thành SO3 từ khí SO2 và oxi xảy ra ở điều kiện nào sau đây?
A. Nhiệt độ phòng.
B. Đun nóng ở 4500C-5000C.
C. Đun nóng ở 4500C-5000C và có mặt xúc tác V2O5.
D. Nhiệt độ phòng và có mặt xúc tác V2O5.
Câu 4: Trong điều kiện thích hợp, lưu huỳnh thể hiện tính khử khi phản ứng với
A. Fe. B. O2. C. H2. D. Hg.
Câu 5: Cặp kim loại nào sau đây phản ứng được với dung dịch H2SO4 đặc, nóng nhưng không phản ứng với dung dịch H2SO4 loãng?
A. Al, Fe. B. Fe, Zn. C. Al, Mg. D. Cu, Ag.
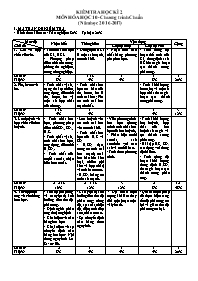
KIỂM TRA HỌC KÌ 2 MÔN HÓA HỌC 10 - Chương trình Chuẩn (Năm học 2016-2017) I. MA TRẬN ĐỀ KIỂM TRA - Hình thức kiểm tra: Trắc nghiệm 80% + Tự luận 20% Mức độ Chủ đề Nhận biết Thông hiểu Vận dụng Cộng Cấp độ thấp Cấp độ cao 1. Clo và hợp chất của clo. - Tính chất hóa học của Cl 2, HCl. - Phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp. - Dung dịch HCl là một axit mạnh, có tính khử. - Nhận biết các chất bằng phương pháp hóa học. - Tính nồng độ hoặc thể tích của Cl 2, dung dịch axit HCl tham gia hoặc tạo thành trong phản ứng. Số câu: Tỉ lệ%: 2 8% 1TL 4% 1 4% 1 8% 5 20% 2. Flo, brom và iot. - Tính chất vật lí, trạng thái tự nhiên, ứng dụng, điều chế flo, brom, iot và một số hợp chất của chúng. - Tính chất hoá học cơ bản của flo, brom, iot là tính oxi hoá; Flo có tính oxi hoá mạnh nhất. - Tính khối lượng brom, iot và một số hợp chất tham gia hoặc tạo thành trong phản ứng. Số câu: Tỉ lệ%: 1TL 4% 1 4% 1 4% 3 12% 3. Lưu huỳnh và hợp chất của lưu huỳnh. - Tính chất hóa học, phương pháp điều chế SO2, SO3, H2S. - Tính chất vật lí, tính chất hóa học, ứng dụng, điều chế H2SO4. - Tính chất của muối sunfat, nhận biết ion sunfat. - Lưu huỳnh vừa có tính oxi hoá vừa có tính khử. - Tính chất hoá học của H2S và SO2 - H2SO4 đặc, nóng có tính oxi hoá mạnh (oxi hoá hầu hết kim loại, nhiều phi kim và hợp chất) và tính háo nước. - H2SO4 loãng có tính axit mạnh. - Viết phương trình hóa học chứng minh tính chất hóa học của lưu huỳnh. - Phân biệt muối sunfat, axit sunfuric với các axit và muối khác. - Tính theo phương trình. - Tính khối lượng lưu huỳnh, hợp chất của lưu huỳnh tham gia và tạo thành trong phản ứng. - Bài tập H2S, SO2 tác dụng với dung dịch kiềm. - Tính nồng độ hoặc khối lượng dung dịch H2SO4 tham gia hoặc tạo thành trong phản ứng. Số câu: Tỉ lệ%: 2 + 2TL 16% 2 + 1TL 12% 3 12% 2 8% 12 48% 4. Tốc độ phản ứng và cân bằng hóa học. - Tốc độ phản ứng và các yếu tố ảnh hưởng đến tốc độ phản ứng. - Định nghĩa phản ứng thuận nghịch - Khái niệm về cân bằng hoá học - Khái niệm về sự chuyển dịch cân bằng hoá học - Nội dung nguyên lí Lơ Sa- tơ- liê. - Các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, áp suất, nhiệt độ, diện tích tiếp xúc, chất xúc tác. - Sự chuyển dịch cân bằng theo nguyên lí. - Dự đoán hiện tượng khi làm thay đổi một hoặc một vài yếu tố. - Đề xuất biện pháp để thực hiện tăng tốc độ phản ứng có lợi và giảm tốc độ phản ứng có hại. Số câu: Tỉ lệ%: 2 8% 1 4% 1 4% 1 4% 5 20% Tổng cộng Số câu: Số điểm: Tỉ lệ%: 9 3,6 36% 6 2,4 24% 5 2,0 20% 5 2,0 20% 25 10,0 100% II. ĐỀ KIỂM TRA VÀ ĐÁP ÁN A. PHẦN TRẮC NGHIỆM Câu 1: Chọn phát biểu không đúng. A. Axit flohidric là axit có tính chất ăn mòn các đồ vật bằng thủy tinh. B. Nước Gia-ven là dung dịch hỗn hợp muối NaCl và NaClO. C. Ở điều kiện thường, iot là chất khí có màu đen tím. D. Brom chỉ oxi hóa được hidro ở nhiệt độ cao tạo ra khí hidrobromua. Câu 2: Chọn phản ứng dùng để điều chế Cl2 trong công nghiệp. A. 2NaCl + 2H2O 2NaOH + H2 + Cl2. B. MnO2 + 4HCl MnCl2 + Cl2 + 2H2O. C. HClO3 + 5HCl 3Cl2 + 3H2O. D. 2HNO3 + 2HCl 2NO2 + Cl2 + 2H2O. Câu 3: Trong công nghiệp, phản ứng hóa học tạo thành SO3 từ khí SO2 và oxi xảy ra ở điều kiện nào sau đây? A. Nhiệt độ phòng. B. Đun nóng ở 4500C-5000C. C. Đun nóng ở 4500C-5000C và có mặt xúc tác V2O5. D. Nhiệt độ phòng và có mặt xúc tác V2O5. Câu 4: Trong điều kiện thích hợp, lưu huỳnh thể hiện tính khử khi phản ứng với A. Fe. B. O2. C. H2. D. Hg. Câu 5: Cặp kim loại nào sau đây phản ứng được với dung dịch H2SO4 đặc, nóng nhưng không phản ứng với dung dịch H2SO4 loãng? A. Al, Fe. B. Fe, Zn. C. Al, Mg. D. Cu, Ag. Câu 6: Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi A. tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. B. nhiệt độ phản ứng không đổi. C. nồng độ mol/l của chất tham gia bằng nồng độ mol/l của sản phẩm. D. các chất phản ứng chuyển hóa hoàn toàn thành các sản phẩm. Câu 7: Trong các phản ứng sau đây, phản ứng nào có tốc độ lớn hơn? A. Zn (thanh) + dung dịch HCl 1M ở 250C. B. Zn (thanh) + dung dịch HCl 1M ở 500C. C. Zn (bột) + dung dịch HCl 1M ở 250C. D. Zn (bột) + dung dịch HCl 1M ở 500C. Câu 8: Cho phản ứng hóa học: Cl2 + 2KBr Br2 + 2KCl. Phản ứng này chứng tỏ A. clo có số oxi hóa (-1) trong mọi hợp chất. B. clo có tính oxi hóa mạnh hơn brom. C. brom có tính oxi hóa mạnh hơn clo. D. clo vừa là chất oxi hóa, vừa là chất khử. Câu 9: Cho sơ đồ chuyển hóa sau: FeS X Y H2SO4. Các chất X, Y lần lượt là: A. SO2 và SO3. B. H2S và SO3. C. S và SO2. D. H2S và SO2. Câu 10: Cho các cặp chất sau: (a) Cl2 và dung dịch KI; (b) SiO2 và dung dịch HF; (c) KMnO4 và dung dịch HCl đặc; (d) dung dịch HF và dung dịch AgNO3; (e) Cl2 và O2; (f) dung dịch HCl và CaCO3; Số cặp chất có xảy ra phản ứng là A. 4. B. 5. C. 2. D. 3. Câu 11: Cho phản ứng xảy ra giữa các cặp chất sau: (a) FeS2 + O2 (b) Na2S2O3 + H2SO4 (loãng) (c) Na2SO3 + HCl (d) H2S + O2 (dư) (e) Al + H2SO4 (loãng) (f) Cu + H2SO4 (đặc) Số phản ứng có sinh ra khí SO2 là A. 6. B. 5. C. 3. D. 4. Câu 12: Cho các cân bằng sau: (a) 2SO2 (k) + O2 (k) 2SO3 (k); (b) CO2 (k) + H2 (k) CO (k) + H2O (k); (c) N2 (k) + 3H2 (k) 2NH3 (k); (d) N2O4 (k) 2NO2 (k) (e) PCl3 (k) + Cl2 (k) PCl5 (k); (f) C (r) + CO2 (k) 2CO (k); Số cân bằng hóa học chuyển dịch theo chiều thuận khi tăng áp suất của hệ là A. 4. B. 2. C. 3. D. 5. Câu 13: Cho 30 gam hỗn hợp bột Cu và Fe tác dụng với dung dịch HCl dư thấy có 1 gam khí H2 thoát ra. Khối lượng của Cu trong hỗn hợp là A. 1 gam. B. 20 gam. C. 2 gam. D. 28 gam. Câu 14: Đốt cháy hoàn toàn m gam lưu huỳnh trong oxi dư thu được 24 gam lưu huỳnh (IV) oxit. Giá trị của m là A. 24. B. 12. C. 6. D. 10. Câu 15: Hòa tan hoàn toàn 9,6 gam Cu trong dung dịch H2SO4 đặc, nóng (dư) thu được V lít khí SO2 là sản phẩm khử duy nhất, đo ở đktc. Giá trị của V là A. 2,24. B. 5,60. C. 1,12. D. 3,36. Câu 16: Cho phản ứng: Br2 + HCOOH 2HBr + CO2. Nồng độ ban đầu của Br2 là 0,012 mol/l, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/l. Tốc độ trung bình của phản ứng trên tính theo Br2 là A. 4.10(mol/l.s). B. 2.10(mol/l.s). C. 4.10(mol/l.s). D. 2.10(mol/l.s). Câu 17: Hòa tan 9,14 gam hợp kim Cu, Mg, Al bằng một lượng vừa đủ dung dịch HCl thu được 7,84 lít khí X (đktc) và 2,54 gam chất rắn Y và dung dịch Z. Lọc bỏ chất rắn Y, cô cạn cẩn thận dung dịch Z thu được lượng muối khan là A. 31,45 gam. B. 33,99 gam. C. 19,025 gam. D. 56,30 gam. Câu 18: Hòa tan hoàn toàn 104,25 gam hỗn hợp X gồm NaCl và NaI vào nước được dung dịch A. Sục khí Cl2 dư vào dung dịch A. Kết thúc thí nghiệm, cô cạn dung dịch thu được 58,5 gam muối khan. Khối lượng NaCl có trong hỗn hợp X là A. 23,4 gam. B. 58,5 gam. C. 29,25 gam. D. 17,55 gam. Câu 19: Hỗn hợp khí X gồm SO2 và CO2 có tỉ khối so với H2 là 27. Dẫn a mol hỗn hợp khí X qua bình đựng 1 lít dung dịch NaOH 1,5a mol/l, thu được dung dịch Y chứa m gam muối. Biểu thức liên hệ giữa m và a là A. m = 141a. B. m = 116a. C. m = 103,5a. D. m = 105a. Câu 20: Cho m gam hỗn hợp X gồm Al và Cu vào dung dịch HCl (dư), sau khi kết thúc phản ứng thu được 3,36 lít khí (đktc). Nếu cho m gam hỗn hợp X trên vào lượng dư dung dịch H2SO4 đặc, nguội thì sau khi kết thúc phản ứng thu được 3,36 lít khí SO2 (sản phẩm khử duy nhất, đo ở đktc). Giá trị của m là A. 15,6. B. 12,3. C. 11,5. D. 10,5. B. PHẦN TỰ LUẬN Viết các phương trình hóa học hoàn thành chuỗi biến hóa sau (ghi rõ điều kiện, nếu có): a) NaCl HCl Cl2 H2SO4 SO2 NaHSO3. b) FeS2 SO2 HBr NaBr NaCl NaOH. c) Na2S2O3 S H2S H2SO4 HCl Cl2. d) NaI NaCl HCl H2S S SO2.
Tài liệu đính kèm:
 kiem_tra_hoc_ki_2_mon_hoa_hoc_lop_10.doc
kiem_tra_hoc_ki_2_mon_hoa_hoc_lop_10.doc





