Kiểm tra 1 tiết lần 1 - Môn kiểm tra: Hóa học 10
I. Mục tiêu đề kiểm tra
1. Kiến thức: Gồm các chủ đề sau:
a) Chủ đề 1: Thành phần cấu tạo nguyên tử.
b) Chủ đề 2: Cấu hình electron nguyên tử.
b) Chủ đề 2: Đồng vị - Nguyên tử khối trung bình.
d) Chủ đề 4: Hóa học hạt nhân.
e) Chủ đề 5: Nhiệt phản ứng.
2. Kĩ năng
a) Giải được bài toán về thành phần cấu tạo của nguyên tử, từ đó tìm ra tên nguyên tố hóa học.
b) Viết thành thạo cấu hình electron nguyên tử, từ đó xác định tính chất hóa học cơ bản.
c) Rèn kĩ năng tính toán NTKTB và % các đồng vị trong tự nhiên.
d) Viết thành thạo phương trình phản ứng hạt nhân. Tính thành thạo chu kì bán hủy.
e) Tính được nhiệt của phản ứng dựa vào một số đại lượng nhiệt hóa.
Bạn đang xem tài liệu "Kiểm tra 1 tiết lần 1 - Môn kiểm tra: Hóa học 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
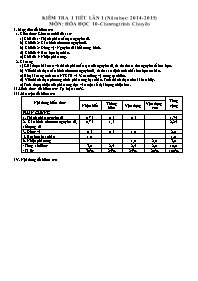
KIỂM TRA 1 TIẾT LẦN 1 (Năm học: 2014 -2015) MÔN: HÓA HỌC 10-Chương trình Chuyên I. Mục tiêu đề kiểm tra 1. Kiến thức: Gồm các chủ đề sau: a) Chủ đề 1: Thành phần cấu tạo nguyên tử. b) Chủ đề 2: Cấu hình electron nguyên tử. b) Chủ đề 2: Đồng vị - Nguyên tử khối trung bình. d) Chủ đề 4: Hóa học hạt nhân. e) Chủ đề 5: Nhiệt phản ứng. 2. Kĩ năng a) Giải được bài toán về thành phần cấu tạo của nguyên tử, từ đó tìm ra tên nguyên tố hóa học. b) Viết thành thạo cấu hình electron nguyên tử, từ đó xác định tính chất hóa học cơ bản. c) Rèn kĩ năng tính toán NTKTB và % các đồng vị trong tự nhiên. d) Viết thành thạo phương trình phản ứng hạt nhân. Tính thành thạo chu kì bán hủy. e) Tính được nhiệt của phản ứng dựa vào một số đại lượng nhiệt hóa. II. Hình thức đề kiểm tra: Tự luận 100%. III. Ma trận đề kiểm tra Nội dung kiến thức Tổng cộng Nhận biết Thông hiểu Vận dụng Vận dụng cao PHẦN CHUNG 1. Thành phần nguyên tử 0,75 0,5 0,5 1,75 2. Cấu hình electron nguyên tử, số lượng tử 0,75 1,5 2,25 3. Đồng vị 0,5 0,5 1,0 2,0 5. Hóa học hạt nhân 1,0 1,0 6. Nhiệt phản ứng 1,0 2,0 3,0 - Tổng số điểm: - Tỉ lệ: 3,0 2,5 2,5 2,0 10,0 30% 25% 25% 20% 100% IV. Nội dung đề kiểm tra SỞ GIÁO DỤC & ĐÀO TẠO NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN KIỂM TRA 1 TIẾT LẦN 1 (2014 - 2015) MÔN: HÓA HỌC 10 (Dành cho lớp 10H) Thời gian làm bài: 45 phút ĐỀ Câu 1: (1 điểm) Cân bằng các phương trình phản ứng hạt nhân sau. Chỉ rõ kí hiệu, số khối, số hiệu nguyên tử của nguyên tố với dấu "?" a) Ca + e ? b) N C + ? Câu 2: (2 điểm) Nguyên tử R có kí hiệu là R. a) Hãy xác định số proton, số nơtron và số electron của nguyên tử R. b) Viết cấu hình electron của nguyên tử R. Cho biết R là kim loại, phi kim hay khí hiếm? Giải thích. c) Viết bộ 4 số lượng tử mô tả electron cuối cùng trong nguyên tử R. Câu 3: (2 điểm) Tìm Z và viết cấu hình electron của các nguyên tử sau: a) Nguyên tử M có số electron trên phân lớp s bằng 1/2 số electron trên phân lớp p và số electron trên phân lớp s kém số electron trên phân lớp p là 6 hạt. b) Nguyên tử X có tổng số hạt proton, nơtron, electron là 76, và có số khối là 52. Câu 4: (2 điểm) Nguyên tử khối trung bình của brom là 79,91. Trong tự nhiên brom có 2 đồng vị bền, trong đó Br chiếm 54,5%. a) Tìm số khối của đồng vị còn lại. b) Hidro có 2 đồng vị: H và H. Viết công thức các loại phân tử hidro bromua khác nhau tạo nên từ hai đồng vị của hai nguyên tố đó. c) Tính số nguyên tử Br có trong 25,782 gam HBrO3 (với H là đồng vị H và O là đồng vị O). Câu 5: (1,5 điểm) Tính nhiệt tạo thành tiêu chuẩn của Ca3(PO4)2 biết: - 10 gam Ca cháy toả ra một nhiệt lượng là 38,0 kcal. - 6,2 gam P cháy toả ra một nhiệt lượng là 37,0 kcal. - 168 gam CaO tác dụng vừa đủ với P2O5 toả ra một nhiệt lượng là 160,5 kcal. Biết hiệu ứng nhiệt được đo trong điều kiện đẳng áp. Câu 6: (1,5 điểm) Tính hiệu ứng nhiệt của phản ứng: C3H6 (mạch hở) + O2 → CO2 + H2O Biết năng lượng liên kết của một số liên kết có giá trị như sau (kJ/mol): EC – C = 348 ; EC=C = 619 ; EC – H = 413 ; EO=O = 498,7 ; EC=O = 707 ; EO – H = 463. (Cho: Ca = 40, P = 31, O = 16, và số Avogadro N = 6,02.1023) --------------HẾT---------------- V. Đáp án LỜI GIẢI TÓM TẮT BIỂU ĐIỂM Câu 1: (1 điểm) Cân bằng các phương trình phản ứng hạt nhân sau. Chỉ rõ kí hiệu, số khối, số hiệu nguyên tử của nguyên tố với dấu "?" a) Ca + e ? b) N C + ? a) Ca + e K 0,5 b) N C + p 0,5 Câu 2: (2 điểm) Nguyên tử R có kí hiệu là R. a) Hãy xác định số proton, số nơtron và số electron của nguyên tử R. b) Viết cấu hình electron của nguyên tử R. Cho biết R là kim loại, phi kim hay khí hiếm? Giải thích. c) Viết bộ 4 số lượng tử mô tả electron cuối cùng trong nguyên tử R. a) - Số proton = 13 = Số electron (Nguyên tử trung hòa điện) - Số nơtron = 27 - 13 = 14 0,75 b) - Cấu hình electron của R: 1s22s22p63s23p1 - R là kim loại vì có 3 electron ở lớp ngoài cùng 0,75 c) Bộ 4 số lượng tử mô tả electron cuối cùng trong nguyên tử R là: n = 3, = 1, m= -1, ms = + 0,5 Câu 3: (2 điểm) Tìm Z và viết cấu hình electron của các nguyên tử sau: a) Nguyên tử M có số electron trên phân lớp s bằng 1/2 số electron trên phân lớp p và số electron trên phân lớp s kém số electron trên phân lớp p là 6 hạt. b) Nguyên tử X có tổng số hạt proton, nơtron, electron là 76, và có số khối là 52. a) - Gọi số hạt electron có trên phân lớp s là a và số electron có trên phân lớp p là b. - Theo đề bài có: a = b a = 6 b - a = 6 b = 12 0,25 Z = 6 + 12 = 18 0,25 - Cấu hình electron của M: 1s22s22p63s23p6 0,5 b) - Đề bài cho: P + N + E = 76 A = 52 - Mà P = E (Nguyên tử trung hòa điện) và A = P + N - Nên ta có hệ phương trình: 2P + N = 76 P + N = 52 0,25 - Giải hệ phương trình trên ta được: P = 24 = Z 0,25 - Cấu hình electron của X là: 1s22s22p63s23p63d54s1 0,5 Câu 4: (2 điểm) Nguyên tử khối trung bình của brom là 79,91. Trong tự nhiên brom có 2 đồng vị bền, trong đó Br chiếm 54,5%. a) Tìm số khối của đồng vị còn lại. b) Hidro có 2 đồng vị: H và H. Viết công thức các loại phân tử hidro bromua khác nhau tạo nên từ hai đồng vị của hai nguyên tố đó. c) Tính số nguyên tử Br có trong 25,782 gam HBrO3 (với H là đồng vị H và O là đồng vị O). a) - Gọi A là số khối của đồng vị thứ hai tỉ lệ phần trăm số nguyên tử của đồng vị Br là 100% - 54,5% = 45,5% - Ta có: 0,25 A = 81. 0,25 b) Công thức các loại phân tử hidro clorua khác nhau: 1H79Br, 1H81Br, 2H79Br, 2H81Br 0,5 c) - M= 1 + 79,91 + 3.16 = 128,91 (g/mol) 0,25 - Số mol HBrO3 = 0,2 mol 0,25 - Số nguyên tử Br trong 0,2 mol HBrO3 = 0,2.6,02.1023 = 1,204.1023 (nguyên tử) 0,25 - Số nguyên tử Br trong 0,2 mol HBrO3 = (ng.tử) 0,25 Câu 5: (1,5 điểm) Tính nhiệt tạo thành tiêu chuẩn của Ca3(PO4)2 biết: - 10 gam Ca cháy toả ra một nhiệt lượng là 38,0 kcal. - 6,2 gam P cháy toả ra một nhiệt lượng là 37,0 kcal. - 168 gam CaO tác dụng vừa đủ với P2O5 toả ra một nhiệt lượng là 160,5 kcal. Biết hiệu ứng nhiệt được đo trong điều kiện đẳng áp. - Nhiệt cháy chuẩn của Ca: (kcal/mol) 0,25 - Nhiệt cháy chuẩn của P: (kcal/mol) 0,25 - Nhiệt của phản ứng: 3CaO + P2O5 → Ca3(PO4)2 là (kcal/mol) 0,25 - Nhiệt tạo thành tiêu chuẩn của Ca3(PO4)2 là nhiệt của phản ứng: 3Ca + 2P + 4O2 → Ca3(PO4)2 = 3 + 2 + = 3.(-152) + 2.(-185) + (-160,5) = - 986,5 (kcal/mol) 0,75 Câu 6: (1,5 điểm) Tính hiệu ứng nhiệt của phản ứng: C3H6 (mạch hở) + O2 → CO2 + H2O Biết năng lượng liên kết của một số liên kết có giá trị như sau (kJ/mol): EC – C = 348 ; EC=C = 619 ; EC – H = 413 ; EO=O = 498,7 ; EC=O = 707 ; EO – H = 463. - Phương trình phản ứng được cân bằng: 2C3H6 + 9O2 → 6CO2 + 6H2O 0,25 Hay: H H H 2 H - C = C - C - H + 9 O = O → 6 O = C = O + 6 H - O - H H 0,25 = 2(EC=C + EC-C + 6EC-H) + 9EO=O - 6.2EC=O - 6.2EO-H = 2(619 + 348 + 6.413) + 9.498,7 - 6.2.707 - 6.2.463 = - 2661,7 (kJ) 1,0 (HS làm cách khác đúng vẫn được điểm tối đa của phần đó)
Tài liệu đính kèm:
 kiem_tra_1_tiet_lan_1_mon_kiem_tra_hoa_hoc_10.doc
kiem_tra_1_tiet_lan_1_mon_kiem_tra_hoa_hoc_10.doc





