Kiểm tra 1 tiết - Bài số 5 môn: Hóa 10
Câu 1 : Hoà tan hoàn toàn hỗn hợp X gồm 1,2g Mg và 6,4g Cu trong dung dịch axit H2SO4 loãng, thấy thoát ra V lít khí H2(đktc). Giá trị của V là
A. 2,24 B. 3,36 C. 1,12 D. 4,48
Câu 2 : Đốt cháy 84g Fe bằng khí O2 trong không khí. Sau phản ứng thu được 106,4g hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4. Số mol khí O2 đã phản ứng là
A. 0,7 mol B. 0,07 mol C. 0,75 mol D. 0,35 mol
Câu 3 : Chỉ ra phát biểu sai:
A. Oxi và ozon có thể tác dụng với Ag ở điều kiện thường
B. Tính oxi hoá của ozon mạnh hơn oxi
C. Oxi và ozon là hai dạng thù hình của nguyên tố Oxi
D. Oxi và ozon là đều có tính oxi hóa
Câu 4 : Trong phản ứng: SO2 + 2H2S → 3S + 2H2O
Câu nào diễn tả đúng tính chất của các chất?
A. SO2 là chất khử và H2S là chất oxi hóa B. SO2 vừa là chất khử vừa là chất oxi hóa
C. SO2 là chất oxi hóa và H2S là chất khử D. H2S vừa là chất khử vừa là chất oxi hóa
Câu 5 : Cấu hình lớp electron ngoài cùng của các nguyên tố nhóm oxi – lưu huỳnh là
A. ns2np4 B. ns2np6 C. ns2np5 D. ns2np3
Câu 6 : Muốn pha loãng dung dịch H2SO4 đặc an toàn, cần phải làm thế nào?
A. Rót nước thật nhanh vào dung dịch axít đặc
B. Rót từ từ nước vào dung dịch axít đặc và khuấy đều
C. Rót nhanh dung dịch axít đặc vào nước
D. Rót từ từ dung dịch axít đặc vào nước và khuấy đều
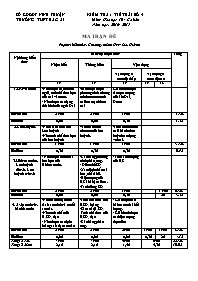
SỞ GD&ĐT NINH THUẬN KIỂM TRA 1 TIẾT BÀI SỐ 5 TRƯỜNG THPT BÁC ÁI Môn: Hóa học 10 - Cơ bản Năm học: 2016- 2017 MA TRẬN ĐỀ Phạm vi kiến thức: Chương: nhóm Oxi – Lưu Huỳnh Nội dung kiến thức Mức độ nhận thức Tổng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức độ thấp Vận dụng ở mức độ cao TN TN TN TN TL 1.Oxi và ozon -Nêu được cấu hình e ngtử, tính chất hoá học của oxi và ozon. - Nêu được các dạng thù hình của ngtố Oxi -Minh họa được phương trình chứng minh ozon có tính oxi hoá mạnh hơn oxi Giải thích được tầm quan trọng của khí Oxi, Ozon Số câu hỏi 2 câu 2 câu 1 câu 5 câu Số điểm 0,6đ 0,6đ 0,3đ 1,5đ 2.Lưu Huỳnh. -Nêu số oxi hoá của Lưu huỳnh -Nêu tính chất hoá học của lưu huỳnh -Viết cấu hình electron của lưu huỳnh. -Tính thể tích của oxi khi cho lưu huỳnh tác dụng với oxi. Số câu hỏi 1 câu 1 câu 1 câu 3 câu Số điểm 0,3đ 0,3đ 0,3đ 0,9đ 3.Hidrosunfua. Lưu huỳnh dioxit. Lưu huỳnh tri oxit - Nêu được tính chất hóa học của Hidrosunfua. -Cân bằng phương trình phản ứng. - Điều chế SO2 -Xác định chất oxi hoá, chất khử. -Hiện tượng của H2S khi bị oxi hoá. -Tách riêng SO2 - Tính khối lượng của H2S Số câu hỏi 2 câu 2 câu 1 câu 1 câu 6câu Số điểm 0,6đ 0,6đ 0,3đ 2đ 3,5đ 4. Axit sunfuric. Muối sunfat -Nêu cách nhận biết Axit sunfuric và muối sunfat. -Nêu tính chất của H2SO4 đặc - Nêu được cách pha loãng axit đặc an toàn -Tính chất hoá của H2SO4 loãng -Sản xuất H2SO4 - Tính chất hoá của H2SO4 đặc -Cân bằng phản ứng. - Giải được cac bài toán tính khối lượng. - Giải thích được các hiện tượng thực tiễn Số câu hỏi 2 câu 2 câu 2 câu 1 câu 1 câu 8câu Số điểm 0,6đ 0,6đ 0,6đ 0,3đ 2đ 4,1đ Tổng số câu Tổng số điểm 7 câu 2,1đ 7 câu 2,1đ 5 câu 1,5đ 3 câu 4,3đ 22 câu 10,0 đ SỞ GD-ĐT NINH THUẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 5) - LỚP 10 TRƯỜNG THPT BÁC ÁI NĂM HỌC 2016-2017 Môn: Hóa học – Chương trình chuẩn Mã đề: 137 Thời gian làm bài: 45 phút (Không kể thời gian phát đề) Đề ra: (Đề kiểm tra có 02 trang) PHẦN TRẮC NGHIỆM (6đ) Câu 1 : Hoà tan hoàn toàn hỗn hợp X gồm 1,2g Mg và 6,4g Cu trong dung dịch axit H2SO4 loãng, thấy thoát ra V lít khí H2(đktc). Giá trị của V là A. 2,24 B. 3,36 C. 1,12 D. 4,48 Câu 2 : Đốt cháy 84g Fe bằng khí O2 trong không khí. Sau phản ứng thu được 106,4g hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4. Số mol khí O2 đã phản ứng là A. 0,7 mol B. 0,07 mol C. 0,75 mol D. 0,35 mol Câu 3 : Chỉ ra phát biểu sai: A. Oxi và ozon có thể tác dụng với Ag ở điều kiện thường B. Tính oxi hoá của ozon mạnh hơn oxi C. Oxi và ozon là hai dạng thù hình của nguyên tố Oxi D. Oxi và ozon là đều có tính oxi hóa Câu 4 : Trong phản ứng: SO2 + 2H2S → 3S + 2H2O Câu nào diễn tả đúng tính chất của các chất? A. SO2 là chất khử và H2S là chất oxi hóa B. SO2 vừa là chất khử vừa là chất oxi hóa C. SO2 là chất oxi hóa và H2S là chất khử D. H2S vừa là chất khử vừa là chất oxi hóa Câu 5 : Cấu hình lớp electron ngoài cùng của các nguyên tố nhóm oxi – lưu huỳnh là A. ns2np4 B. ns2np6 C. ns2np5 D. ns2np3 Câu 6 : Muốn pha loãng dung dịch H2SO4 đặc an toàn, cần phải làm thế nào? A. Rót nước thật nhanh vào dung dịch axít đặc B. Rót từ từ nước vào dung dịch axít đặc và khuấy đều C. Rót nhanh dung dịch axít đặc vào nước D. Rót từ từ dung dịch axít đặc vào nước và khuấy đều Câu 7 : Oxi không phản ứng trực tiếp với A. flo B. lưu huỳnh C. cacbon D. nhôm Câu 8 : Cho các chất sau: SO2, SO3, Al2O3, CaO. Có bao nhiêu chất là oxit axit? A. 1 B. 2 C. 3 D. 4 Câu 9 : Để nhận ra sự có mặt của ion sunfat trong dung dịch người ta thường dùng A. quỳ tím B. dd AgNO3 C. dd chứa ion Ba2+ D. thuốc thử duy nhất là Ba(OH)2 Câu 10 : Chất dùng làm sạch nước và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ tia cực tím là A. O3 B. CO2 C. O2 D. SO2 Câu 11 : Chất nào sau đây chỉ thể hiện tính khử? A. SO2 B. H2S C. O3 D. H2SO4 Câu 12 : Dãy kim loại phản ứng được với dd H2SO4 loãng là: A. Cu, Zn, Na B. Ag, Ba, Fe C. Mg, Al, Ca D. Au, Pt, Al Câu 13 : Thể tích khí SO2 hình thành (đo ở đktc) là bao nhiêu khi đốt cháy hoàn toàn 100g bột lưu huỳnh trong khí O2? A. 35 lít B. 39,9 lít C. 70 lít D. 79,8 lít Câu 14 : Số oxi hoá có thể có của lưu huỳnh là: A. −2, −4, +6, 0 B. −2, +4, 0, +6 C. −2, +4, +6 D. −1, 0, +4, +2 Câu 15 : Cho axit H2SO4 đặc vào cốc có chứa đường ăn, thấy đường bị hóa đen. Đó là tính chất nào của axit H2SO4 đặc? A. Tính axit B. Tính oxi hóa C. Tính tỏa nhiệt D. Tính háo nước Câu 16 : Đồ dùng bằng bạc để lâu ngày trong không khí bị sạm đen do phản ứng: 4Ag + 2H2S + O2 → 2Ag2S + 2H2O Trong phản ứng trên chất đóng vai trò chất khử là A. H2S B. Ag C. O2 D. Ag và H2S Câu 17 : Khí oxi có lẫn hơi nước thì chất nào sau đây là tốt nhất để tách hơi nước ra khỏi khí oxi? A. Nhôm oxit B. Axit sunfuric đặc C. Dung dịch natri hiđroxit D. Nước vôi trong Câu 18 : Để phân biệt 3 dung dịch không màu riêng rẽ: H2SO4, NaCl, Na2SO4 cần dùng thuốc thử là A. dd AgNO3 B. quỳ tím và BaCl2 C. dd BaCl2 D. nước Brom Câu 19 : Kim loại nào sau đây tác dụng với dd H2SO4 loãng và với dd H2SO4 đặc, nóng thì cho ra 2 loại muối khác nhau? A. Mg B. Zn C. Al D. Fe Câu 20 : Câu sau gồm hai ý: H2S là một chất khử mạnh và là axit yếu. H2SO4 đặc là một chất oxi hóa mạnh và có tính hút nước mạnh. Hai ý trên thì: A. Cả 2 ý đều sai B. Ý 1 đúng, ý 2 sai C. Ý 1 sai, ý 2 đúng D. Cả 2 ý đều đúng PHẦN TỰ LUẬN (4đ) Câu 1: (2 điểm) Viết các phương trình phản ứng xảy ra cho sơ đồ chuyển hóa sau: Câu 2: (2 điểm) Hoà tan hoàn toàn Cu trong lượng dư dd H2SO4 đặc, đun nóng. Sau khi phản ứng kết thúc thì thu được dd X và 3,36 lít khí SO2(đktc). a/ Tính khối lượng Cu đã tham gia phản ứng. b/ Tính khối lượng muối sunfat thu được sau khi cô cạn dung dịch X. (Cho biết khối lượng nguyên tử của: Fe=56; Mg=24; O=16; S=32; Cu=64) --- Hết --- SỞ GD – ĐT NINH THUẬN TRƯỜNG THPT BÁC ÁI Đề chính thức ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 5) – LỚP 10 NĂM HỌC 2016 – 2017 Môn: Hóa học – Chương trình chuẩn ĐÁP ÁN ĐỀ 137 A/ TRẮC NGHIỆM (6 điểm) Câu 1 2 3 4 5 6 7 8 9 10 Đ/án C A A C A D A B C A Câu 11 12 13 14 15 16 17 18 19 20 Đ/án B C C B D B B D D D B/ TỰ LUẬN (4 điểm) CÂU ĐÁP ÁN ĐIỂM 1 0,4 0,4 0,4 0,4 0,4 2 số mol SO2=0,15 viết ptpư số mol Cu = 0,15 khối lượng Cu= 9,6g số mol CuSO4 = 0,15 khối lượng CuSO4= 24g 0,25 0,25 0,25 0,5 0,25 0,5
Tài liệu đính kèm:
 kiem_tra_1_tiet_bai_so_5_mon_hoa_10.doc
kiem_tra_1_tiet_bai_so_5_mon_hoa_10.doc





