Giải bài toán oxit axit tác dụng với bazo và kim loại lưỡng tính Al ,Zn
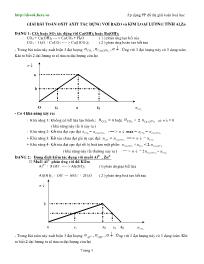
DẠNG 1: CO2hoặc SO2
tác dụng với Ca(OH)
2
hoặc Ba(OH)2
CO2
+ Ca(OH)2--- > CaCO
3+ H2
O ( 1 ) phản ứng tạo kết tủa
CO2+ H2O + CaCO3---- > Ca(HCO
3
)
2
( 2 ) phản ứng hoàn tan kết tủa
- Trong bài toàn này xuất hiện 3 ñại lượng ↓ n n n
OH Ca CO
, ,
2 2
) (
. Ứng với 3 ñại lượng này có 3 dạng toán.
Khi ta biết 2 ñại lượng ta sẽ tìm ra ñại lượng còn lại
Bạn đang xem tài liệu "Giải bài toán oxit axit tác dụng với bazo và kim loại lưỡng tính Al ,Zn", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
Áp dụng PP ñồ thị giải toán hoá học Trang 1 GIẢI BÀI TOÁN OXIT AXIT TÁC DỤNG VỚI BAZO và KIM LOẠI LƯỠNG TÍNH Al,Zn DẠNG 1: CO2 hoặc SO2 tác dụng với Ca(OH)2 hoặc Ba(OH)2 CO2 + Ca(OH)2 --- > CaCO3 + H2O ( 1 ) phản ứng tạo kết tủa CO2 + H2O + CaCO3 ---- > Ca(HCO3)2 ( 2 ) phản ứng hoàn tan kết tủa - Trong bài toàn này xuất hiện 3 ñại lượng ↓nnn OHCaCO ,, 22 )( . Ứng với 3 ñại lượng này có 3 dạng toán. Khi ta biết 2 ñại lượng ta sẽ tìm ra ñại lượng còn lại ↓n a b O x1 a x2 2CO n - Có 4 khả năng xảy ra: + Khả năng 1: Không có kết tủa tạo thành.: 2CO n = 0 hoặc 2CO n ≥ 2 2)(OHCa n ⇒ ↓n = 0 ( khả năng này rất ít xảy ra ) + Khả năng 2: Kết tủa ñạt cực ñại 2CO n = 2)(OHCa n : == > ↓n max = 2CO n = 2)(OHCa n + Khả năng 3: Kết tủa chưa ñạt giá trị cực ñại: 2CO n < 2)(OHCa n == > ↓n = 2CO n + Khả năng 4: Kết tủa ñạt cực ñại rồi bị hoà tan một phần: 2)(OHCa n < 2CO n < 2. 2)(OHCa n ( khả năng này rất thường xảy ra ) == > ↓n = 2 2)(OHCa n - 2CO n DẠNG 2: Dung dịch kiềm tác dụng với muối Al3+ , Zn2+ ☼ Muối Al3+ phản ứng với dd Kiềm Al3+ + 3 OH- ---- > Al(OH)3 (1) phản ứngtạo kết tủa Al(OH)3 + OH - --- AlO2 - + 2H2O ( 2 ) phản ứng hoà tan kết tủa ↓n b 0 x1 3a x2 4a 2CO n - Trong bài toàn này xuất hiện 3 ñại lượng ↓−+ nnn OHAl ,,3 . Ứng với 3 ñại lượng này có 3 dạng toán. Khi ta biết 2 ñại lượng ta sẽ tìm ra ñại lượng còn lại Áp dụng PP ñồ thị giải toán hoá học Trang 2 - Có 4 khả năng xảy ra: + Khả năng 1: Không có kết tủa tạo thành.: − OH n = 0 hoặc − OH n ≥ 4 +3 Al n ⇒ ↓n =0 ( khả năng này rất ít xảy ra ) + Khả năng 2: Kết tủa ñạt cực ñại − OH n = 3. +3 Al n ⇒ ↓n max = +3 Al n = 3 1 − OH n + Khả năng 3: Kết tủa chưa ñạt giá trị cực ñại thì OH- hết: − OH n < +3 Al n ⇒ ↓n = 3 1 − OH n + Khả năng 4: Kết tủa ñạt cực ñại rồi bị hoà tan một phần: 3. +3 Al n < − OH n < 4. +3 Al n ( khả năng này rất thường xảy ra ) == > ↓n = 4 +3 Al n - − OH n ☼ Muối Zn2+ phản ứng với dd Kiềm Zn2+ + 2 OH- ---- > Zn(OH)2 (1) phản ứngtạo kết tủa Zn(OH)2 + 2 OH - --- > ZnO2- + H2O ( 2 ) phản ứng hoà tan kết tủa ↓n b 0 x1 2a x2 4a 2CO n - Trong bài toàn này xuất hiện 3 ñại lượng ↓−+ nnn OHZn ,,2 . Ứng với 3 ñại lượng này có 3 dạng toán. Khi ta biết 2 ñại lượng ta sẽ tìm ra ñại lượng còn lại - Có 4 khả năng xảy ra: + Khả năng 1: Không có kết tủa tạo thành.: − OH n = 0 hoặc − OH n ≥ 4 +2 Zn n ⇒ ↓n =0 ( khả năng này rất ít xảy ra ) + Khả năng 2: Kết tủa ñạt cực ñại − OH n = 2. +2 Zn n ⇒ ↓n max = +2 Zn n = 2 1 − OH n + Khả năng 3: Kết tủa chưa ñạt giá trị cực ñại thì OH- hết : − OH n < +3 Al n ⇒ ↓n = 2 1 − OH n + Khả năng 4: Kết tủa ñạt cực ñại rồi bị hoà tan một phần: 3. +3 Al n < − OH n < 4. +3 Al n ( khả năng này rất thường xảy ra ) == > ↓n = 4 +3 Al n - − OH n DẠNG 3: Axit tác dụng với AlO2 - và ZnO2- ☼ AlO2 - tác dụng với axit: AlO2 - + H+ + H2O ------ > Al(OH)3 Al(OH)3 + 3 H + ------- > Al3+ + 3H2O Áp dụng PP ñồ thị giải toán hoá học Trang 3 ↓n a 0 x1 a x2 4a + H n + Khả năng 1: Không có kết tủa tạo thành.: + H n = 0 hoặc + H n ≥ 4 − 2AlO n ⇒ ↓n =0 ( khả năng này rất ít xảy ra ) + Khả năng 2: Kết tủa ñạt cực ñại + H n = − 2AlO n ⇒ ↓n max = − 2AlO n = + H n + Khả năng 3: Kết tủa chưa ñạt giá trị cực ñại thì H+ hết : + H n < − 2AlO n ⇒ ↓n = + H n + Khả năng 4: Kết tủa ñạt cực ñại rồi bị hoà tan một phần: − 2AlO n < + H n < 4. − 2AlO n ( khả năng này rất thường xảy ra ) == > ↓n = 3 4 − 2AlO n - 3 1 + H n ☼ ZnO2- tác dụng với dd axit: ZnO2- + 2H+ + H2O -------- > Zn(OH)2 Zn(OH)2 + 2H2 ------ > Zn + + H2O ↓n a b 0 x1 2a x2 4a + H n + Khả năng 1: Không có kết tủa tạo thành.: + H n = 0 hoặc + H n ≥ 4 +2 Zn n ⇒ ↓n =0 ( khả năng này rất ít xảy ra ) + Khả năng 2: Kết tủa ñạt cực ñại + H n = 2. −2 ZnO n ⇒ ↓n max = −2 ZnO n = 2 1 + H n + Khả năng 3: Kết tủa chưa ñạt giá trị cực ñại thì H+ hết : + H n < −2 ZnO n ⇒ ↓n = 2 1 + H n + Khả năng 4: Kết tủa ñạt cực ñại rồi bị hoà tan một phần: 2. −2 ZnO n < + H n < 4. −2 ZnO n ( khả năng này rất thường xảy ra ) == > ↓n = 2 +3 Al n - 2 1 − OH n Áp dụng PP ñồ thị giải toán hoá học Trang 4 BÀI TẬP ÁP DỤNG Bài 1: Dẫn V lít khí CO2 (ñktc) vào bình ñựng 2 lít dd Ca(OH)2 0,01M thu ñược 1g kết tủa. Xác ñịnh V? Bài 2:Dẫn khí CO2 vào dd chứa 0.15 mol Ca(OH)2 thu ñược 10 gam kết tủa . Tính số mol CO2 cần dùng A. 0.1 mol B. 0.15 mol C. 0.1 và 0.2 ml D. 0.1 và 0.15 mol Bài 3:Cho V lít khí CO2 (ñkc ) hấp thụ hết vào 100 ml dd Ca(OH)2 0.7M kết thúc thí nghiệm thu ñựợc 4 gam kết tủa. Giá trị của V A. 1.568 lít B. 1.568 lít hoặc 0.896 lít C. 0.896 lít duy nhất D. 0.896 lít hoặc 2.24 lít Bài 4: Cho 2,8g CaO tác dụng với nước dư thu ñược dd A. Dẫn 1,68 lít CO2 (ñktc) vào dd A. Tính lượng kết tủa thu ñược? Bài 5: Hấp thụ hoàn toàn 2,688 lít khí CO2 (ñktc) vào 2,5 lít dd Ba(OH)2 nồng ñộ mol/l, thu ñược 15,76g kết tủa. Tính giá trị a. Bài 6: Cho V lít khí CO2 hấp thụ hoàn toàn vào 450ml dd Ba(OH)2 0.2M thì thu ñược 15.76 ga kết tủa. Giá trị của V là: A. 1.792 lít B. 2.24 lít C. 2.016 lít D Cả A và B Bai 7: Cho m gam Na tan hết trong 100 ml dd Al2(SO4)3 0.2M. Sau phản ứng thu ñược 0.78 g kết tủa. Giá trị của m là: A. 0.69 g B. 2.76 g C. 2.45 g D. 1.69 g Bài 8: Cho 4,005g AlCl3 vào 1000ml dd NaOH 0,1M. Sau khi phản ứng xong thu ñược bao nhiêu gam kết tủa? Bài 9: Hoà tan hết m gam ZnSO4 vào nước ñược dd X. Cho 110 ml dd KOH 2M vào X, thu ñược a gam kết tủa. Mặt khác, nếu cho 140ml dd KOH vào X thì cũng thu ñược a gam kết tủa. Tính m. Bài 10: Cho 100ml dd chứa ñồng thời KOH 0.8M và Ba(OH)2 0.5M tác dụng hết với V ml dd AlCl3 0.5M. Sau phản ứng thu ñược 1.56 g kết tủa. Tính V Bài 11: Cho 100ml dd AlCl3 tác dụng với 200ml dd NaOH. Kết tủa tạo thành làm khô nung ñến khối lượng không ñổi cân nặng 2,55g. Tính nồng ñộ mol NaOH ban ñầu. Bài 12:Rót từ từ dd Ba(OH)2 0.2M vào 150 ml dd AlCl3 0.04 M ñến khi thu ñược kết tủa. Tính giá trị thể tích Ba(OH)2 ñể thu ñược kết tủa lớn nhất hoặc kết tủa nhỏ nhất A. 45 ml và 60 ml B. 60 ml và 45 ml C. 90 ml và 120 ml D. 45 ml và 90 ml Bài 13: Hoà tan vừa hết m gam Al vào dd NaOH thì thu ñược dd A và 3,36 lít H2 (ñktc). a. Tính m b. Rót từ từ dd HCl 0.2M vào A thì thu ñuợc 5.46 gam kết tủa. Tính thể tích dd HCl ñã dùng Bài 14: Rót từ từ dd HCl 0.1M vào 200 ml dd KAlO2 . Sau phản ứng thu ñược 1.56 gam kết tủa. Tính thể tích dd HCl ñã dùng A. 0.2 và 1 lít B. 0.4 và 1 lít C. 0.2 và 0.8 lít D. 0.4 và 1 lít
Tài liệu đính kèm:
 Giai-BT-Oxit-Bazo-Bang-Do-Thi.pdf
Giai-BT-Oxit-Bazo-Bang-Do-Thi.pdf





