Đề kiểm tra kì I lớp 10 - Môn: Hóa Học
Câu 1. (2đ) Viết cấu hình electron của các nguyên tử và ion sau: 16S; 19K; 11Na+; 8O2-
Câu 2. (3đ) Cho 3 nguyên tố 14X, 7Y, 6Z.
a) Viết cấu hình electron nguyên tử, xác định vị trí
b) So sánh tính phi kim của các nguyên tố trên. Giải thích.
Câu 3. (3đ) Viết công thức electron và công thức cấu tạo của các hợp chất sau: HCl; NH3; CO2
Câu 4. (2đ) Trong một nguyên tử, tổng số các hạt cơ bản là 28. Trong đó số hạt không mang điện nhiều hơn số hạt mang điện dương là 1.
a) Tính số khối của nguyên tử trên
b) Nguyên tử trên là kim loại, phi kim hay khí hiếm. Giải thích.
Bạn đang xem tài liệu "Đề kiểm tra kì I lớp 10 - Môn: Hóa Học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
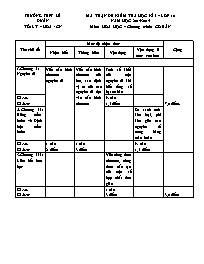
TRƯỜNG THPT LÊ DUẨN TỔ: LÝ – HÓA - CN MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I – LỚP 10 NĂM HỌC 2014-2015 Môn: HÓA HỌC – Chương trình: CƠ BẢN Tên chủ đề Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn Chương I: Nguyên tử Viết cấu hình electron nguyên tử Viết cấu hình electron của ion, xác định vị trí của các nguyên tử dựa vào cấu hình electron Tính số khối của một nguyên tử khi biết tổng số hạt cơ bản 7,0 điểm. Số câu Số điểm ½ câu 1,5 điểm 2. Chương II: Bảng tuần hoàn và Định luật tuần hoàn So sánh tính kim loại, phi kim giữa các nguyên tố trong bảng tuần hoàn Số câu Số điểm 1 câu 2 điểm 1 câu 3 điểm ½ câu 1,5 điểm 3.Chương III: Liên kết hóa học Viết công thức electron, công thức cấu tạo của một số hợp chất đơn giản Số câu Số điểm 1 câu 3 điểm 3,0 điểm TRƯỜNG THPT LÊ DUẨN TỔ: LÝ – HÓA – CN (Đề kiểm tra có 01 trang) ĐỀ KIỂM TRA HỌC KÌ I – LỚP 10 NĂM HỌC 2014-2015 Môn: HÓA HỌC – Chương trình: CƠ BẢN Thời gian: 45 phút( không kể thời gian phát đề) Câu 1. (2đ) Viết cấu hình electron của các nguyên tử và ion sau: 16S; 19K; 11Na+; 8O2- Câu 2. (3đ) Cho 3 nguyên tố 14X, 7Y, 6Z. Viết cấu hình electron nguyên tử, xác định vị trí So sánh tính phi kim của các nguyên tố trên. Giải thích. Câu 3. (3đ) Viết công thức electron và công thức cấu tạo của các hợp chất sau: HCl; NH3; CO2 Câu 4. (2đ) Trong một nguyên tử, tổng số các hạt cơ bản là 28. Trong đó số hạt không mang điện nhiều hơn số hạt mang điện dương là 1. Tính số khối của nguyên tử trên Nguyên tử trên là kim loại, phi kim hay khí hiếm. Giải thích. .HẾT TRƯỜNG THPT LÊ DUẨN TỔ: LÝ – HÓA - CN ĐÁP ÁN KIỂM TRA HỌC KÌ I - NĂM 2014-2015 Môn: HÓA HỌC 10 - Thời gian: 45 phút ĐỀ 1: Câu Đáp án Điểm Câu 1 (2đ ) 16S 1s22s22p63s23p4 19K 1s22s22p63s23p64s1 11Na+ 1s22s22p6 8O2- 1s22s22p6 0,5đ 0,5đ 0,5đ 0,5đ Câu 2 (3đ ) 14X: 1s22s22p63s23p2 ô thứ 14, chu kì 3, nhóm IVA 7Y: 1s22s22p3 ô thứ 7, chu kì 2, nhóm VA 6Z: 1s2 2s2 2p2 ô thứ 6, chu kì 2, nhóm IVA Z và Y cùng thuộc một chu kì, khi đthn tăng tính phi kim tăng → Z có tính phi kim yếu hơn Y X và Z cùng thuộc một nhóm IVA, khi đthn tăng tính phi kim giảm → Z có tính phi kim mạnh hơn X → Sắp xếp theo thứ tự tăng dần tính phi kim: X < Z< Y 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ Câu 3 (3đ ) Công thức electron Công thức cấu tạo H – Cl O = C = O 1,0đ 1,0đ 1,0đ Câu 4 (2đ) P + e + n = 28 ↔ 2p + n = 28 (1) n – p = 1 (2) Từ (1), (2) → p = 9; n = 10 A = n + p = 10 + 9 = 19 Nguyên tử trên là phi kim. Vì cấu hình electron nguyên tử là 1s22s22p5 có 7e lớp ngoài cùng 0,25đ 0,25đ 0,25đ 0,5đ 0,25đ 0,25đ 0,25đ
Tài liệu đính kèm:
 de_kiem_tra_ki_i_lop_10_mon_hoa_hoc.doc
de_kiem_tra_ki_i_lop_10_mon_hoa_hoc.doc





