Đề kiểm tra kì I lớp 10 - Môn Hóa (cơ bản)
Câu 1: ( 3,0 điểm)
Cho kí hiệu nguyên tử sau : 1531R
a) Cho biết số proton, số eclectron, số nơtron và điện tích hạt nhân của nguyên tố trên.
b) Viết cấu hình electron của R và R3- và xác định vị trí của R trong bảng tuần hoàn.
c) Viết công thức hợp chất với oxi và hidro của R.
Câu 2: ( 3,0 điểm)
Cho biết : N( Z = 7 ); H(Z =1)
a) Viết công thức electron và công thức cấu tạo của NH3.
b) Xác định số oxi hóa của nitơ trong hợp chất sau: HNO3 ;NH3.
c) Xác định cộng hóa trị của NH3 và điện hóa trị của CaCl2 .
Câu 3: ( 2,0 điểm )
Trong tự nhiên nguyên tố brom có hai đồng vị là 79Br và 81Br , biết nguyên tử khối trung bình của brom là 79,82. Hãy xác định thành phần phần trăm số nguyên tử của mỗi đồng vị.
Câu 4: ( 2,0 điểm ).
Một nguyên tố R ứng với công thức RH2. Hợp chất của nó với oxi có chứa 60 % oxi về khối lượng.
a) Xác định nguyên tử khối của R.
b) Viết cấu hình electron và cho biết tính chất của R. Biết trong nguyên tố R có số hạt nơtron bằng số hạt proton.
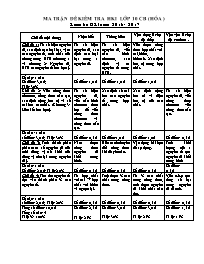
MA TRẬN ĐỀ KIỂM TRA HKI LỚP 10 CB (HÓA ) Kiểm tra HKI năm: 2016 - 2017 Chủ đề (nội dung) Nhận biết Thông hiểu Vận dụng ở cấp độ thấp Vận vận ở cấp độ cao hơn . Chủ đề 1: Từ số hiệu nguyên tử, xác định các loại hạt, vị trí các nguyên tố, tính chất của chúng trong BTH (chương 1 và chương 2: Nguyên tử, BTH các nguyên tố hóa học ). Từ số hiệu nguyên tử, xác định các loại hạt trong 1 nguyên tử. Từ số hiệu nguyên tử, viết cấu hình electron, xác định vị trí nguyên tố trong BTH. Viết được công thức hợp chất với oxi,hidro, hidroxit. Xác định hóa trị trong hợp chất. Số câu: 1 câu Số điểm: 3,0 đ; Tỉ lệ: 30% Số điểm: 1,0 đ Số điểm: 1,0 đ Số điểm: 1,0 đ Chủ đề 2: Viết công thức electron, công thức cấu tạo, xác định cộng hóa trị và số oxi hóa các chất. (Chương 3: Liên kết hóa học). Từ số hiệu nguyên tử, viết cấu hình electron theo lớp để viết công thức electron và công thức cấu tạo. Xác định số oxi hóa các nguyên tố trong hợp chất. Xác định cộng hóa tri và điện hóa trị của các chất. Từ số hiệu nguyên tử, viết công thức electron viết công thức cấu tạo. Số câu : 1 câu số điểm: 3,0 đ; Tỉ lệ: 30% Số điểm: 0,5 đ Số điểm:1,0 đ Số điểm: 1,0đ Số điểm: 0,5 đ Chủ đề 3: Tính thành phần phần trăm số nguyên tử của mỗi đồng vị (số khối của đồng vị còn lại trong nguyên tử ). Nắm được công thức nguyên tử khối trung bình. Biết cách chuyển đổi công thức khi đề yêu cầu. Vận dụng bài học để áp dụng. Tính khối lượng của 1 nguyên tố qua nguyên tử khối trung bình Số câu: 1 câu Số điểm: 2,0 đ; Tỉ lệ:2,0% Số điểm: 0,5 đ Số điểm: 0,5 đ Số điểm: 0,5 đ Số điểm: 0,5 đ Chủ đề 4: Tìm tên nguyên tố dựa vào thành phần % các nguyên tố. Từ hợp chất với oxi è hợp chất với hidro và ngược lại. Tính được % các chất trong công thức. Từ % các chất trong công thức, tính được nguyên tử khối chất cần tìm. Viết c.h.e qua tổng số hạt trong nguyên tử đã tính. Số câu: 1 câu số điểm: 2,0 đ; Tỉ lệ: 20% Số điểm: 0,5 đ Số điểm: 0,5 đ Số điểm: 0,5 đ Số điểm: 0,5 đ Tổng số điểm: 10,0 đ Tổng số câu : 4 Tỉ lệ %: 100% Số điểm: 2,5 đ Tỉ lệ: 25% Số điểm: 3,0 đ Tỉ lệ: 30% Số điểm: 3,0 đ Tỉ lệ: 25% Số điểm: 1,5 đ Tỉ lệ: 15% Sở GD – ĐT NINH THUẬN ĐỀ KIỂM TRA: HKI ; LỚP 10 CB Trường THPT Phạm Văn Đồng NĂM HỌC: 2016 -2017 Họ và tên: MÔN: HÓA ; Chương trình: Cơ Bản Lớp: 10C Thời gian làm bài : 45 phút ( Không kể thời gian chép đề ) ĐỀ 1: Câu 1: ( 3,0 điểm) Cho kí hiệu nguyên tử sau : 1531R a) Cho biết số proton, số eclectron, số nơtron và điện tích hạt nhân của nguyên tố trên. b) Viết cấu hình electron của R và R3- và xác định vị trí của R trong bảng tuần hoàn. c) Viết công thức hợp chất với oxi và hidro của R. Câu 2: ( 3,0 điểm) Cho biết : N( Z = 7 ); H(Z =1) a) Viết công thức electron và công thức cấu tạo của NH3. b) Xác định số oxi hóa của nitơ trong hợp chất sau: HNO3 ;NH3. c) Xác định cộng hóa trị của NH3 và điện hóa trị của CaCl2 . Câu 3: ( 2,0 điểm ) Trong tự nhiên nguyên tố brom có hai đồng vị là 79Br và 81Br , biết nguyên tử khối trung bình của brom là 79,82. Hãy xác định thành phần phần trăm số nguyên tử của mỗi đồng vị. Câu 4: ( 2,0 điểm ). Một nguyên tố R ứng với công thức RH2. Hợp chất của nó với oxi có chứa 60 % oxi về khối lượng. a) Xác định nguyên tử khối của R. b) Viết cấu hình electron và cho biết tính chất của R. Biết trong nguyên tố R có số hạt nơtron bằng số hạt proton. ( Chú ý: Không sử dụng bảng tuần hoàn ). BÀI LÀM Sở GD – ĐT NINH THUẬN ĐỀ KIỂM TRA: HKI ; LỚP 10 CB Trường THPT Phạm Văn Đồng NĂM HỌC: 2016 -2017 Họ và tên : MÔN: HÓA ; Chương trình: Cơ Bản Lớp : 10C Thời gian làm bài: 45 phút ( Không kể thời gian chép đề ) ĐỀ 2: Câu 1: ( 3,0 điểm ). Cho kí hiệu nguyên tử sau : 2412R a) Cho biết số proton, số eclectron ,số nơtron và điện tích hạt nhân của nguyên tố trên. b ) Viết cấu hình electron của R, R2+ và xác định vị trí của R trong bảng tuần hoàn. c) Viết công thức hợp chất với oxi và hidroxit của R. Câu 2: ( 3,0 điểm). Cho biết: C( Z = 6 ); H(Z =1) a) Viết công thức electron và công thức cấu tạo của CH4. b) Xác định số oxi hóa của S trong hợp chất sau: H2SO4 ; H2S. c) Xác định cộng hóa trị của CH4 và điện hóa trị của Na2S. Câu 3: ( 2,0 điểm ). Trong tự nhiên nguyên tố đồng có hai đồng vị trong đó 63Cu chiếm 73%. Biết tử khối trung bình của đồng là 63,64. Hãy xác định số khối đồng vị thứ 2 của đồng. Câu 4: ( 2,0 điểm ). Một nguyên tố R ứng với công thức R2O5. Hợp chất của nó với hidro có chứa 8,82 % hidro về khối lượng. a) Xác định nguyên tử khối của R. b) Viết cấu hình electron và cho biết tính chất của R. Biết trong nguyên tố R có số hạt nơtron nhiều hơn hạt proton là 1. ( Chú ý : Không sử dụng bảng tuần hoàn ). BÀI LÀM ................................................ ................................................ Đáp án Hướng dẫn chấm và biểu điểm (Hóa 10 CB) Kiểm tra HKI năm: 2016- 2017 ĐỀ 1: Đáp án và hướng dẫn chấm Biểu điểm Câu 1: (3,0 ñieåm). a) số p = số e = 15, số n = 31 - 15 = 16 , điện tích hạt nhân: 15+ b) R (Z= 15) : 1s22s22p63s23p3 R + 3e à R3- 1s22s22p63s23p6 à ô nguyên tố : 15 chu kỳ: 3 vì có 3 lớp electron nhóm: VA vì có 5 electron ở lớp ngoài cùng c) Công thức với oxi: R2O5 Công thức với hidro: RH3 0,5 đ 0,5 đ 0,5 đ 0,5 đ 0,5 đ 0,5 đ Câu 2: (3,0 ñieåm). a) N : 2/5 thiếu 3 e H : 1 thiếu 1e . . H : N : H ; H- N - H H H Công thức e công thức cấu tạo b) Cấu hình electron : HNO3 ; NH3 . + HNO3 : +1 + x + 3(-2) = 0 à x = + 5 + NH3 : x + 3(+1) = 0 à x = -3 c) H- N - H à Cộng hóa trị của N = 3, của H =1 H CaCl2 : Điện hóa trị của Ca = 2+ ,Cl = 1- 1,0 đ 0,5 đ 0,5 đ 0,5 đ 0,5 đ Câu 3: (2,0 ñieåm). Gọi x1 là thành phần % số nguyên tử của đồng vị 81Br x2= 100 - x1 là thành phần % số nguyên tử của đồng vị 79Br A1x1 + A2x2 81.x1 + 79(100 -x2) A= à = 79,82 100 100 à 81x1 - 79x1 + 7900 = 7982 à 2x1 = 82 à x1 = 41% Mà x2 = 100 -x 1 = 100 - 41 = 59% 1,0 đ 1,0 ñ Câu 4: (2,0 ñieåm). a) %R = 100 – 60 = 40 % RH2 à Công thức hợp chất với oxi là : RO3 MR 3.MO MR 3.16 = à = à MR = 32 %R %O 40 60 b) MR =AR = Z + N = 32 Mà : N = Z à Z + Z = 32 à Z = 16 Z= 16 : 1s22s22p63s23p4 à có tính phi kim vì có 6 electron ở lớp ngoài cùng 1,0 ñ 0,5 ñ 0,5 ñ Đáp án Hướng dẫn chấm và biểu điểm (Hóa 10 CB) Kiểm tra HKI năm: 2016- 2017 ĐỀ 2: Đáp án và hướng dẫn chấm Biểu điểm Câu 1: (3,0 ñieåm ). a) số p = số e = 12 , số n = 24 - 12 = 12 , điện tích hạt nhân : 12+ b) R (Z= 12) : 1s22s22p63s2 R à R2+ + 2e : 1s22s22p6 à ô nguyên tố : 12 chu kỳ :3 vì có 3 lớp electron nhóm :IIA vì có 2 electron ở lớp ngoài cùng c) Công thức với oxi : RO Công thức với hidro : R(OH)2 0,5 đ 0,5 đ 0,5 đ 0,5 đ 0,5 đ Câu 2: (3,0 ñieåm ). a) C : 2/4 thiếu 4 e H : 1 thiếu 1e H H H : C : H ; H- C - H H H Công thức e công thức cấu tạo b) Cấu hình electron : H2SO4 , H2S . + H2SO4 : 2(+1) + x + 4(-2) = 0 => x = +6 + H2S : 2(+1) + x = 0 => x = -2 0 +6 + 4 +4 c) H H- C - H Cộng hóa trị của C = 4 ; H = 1 H Na2S điện hóa trị của Na = 1+; S = 2- 1,0 đ 0,5 đ 0,5 đ 0,5 đ 0,5 đ Câu 3: (2,0 ñieåm ). Vì: x1 + x2 à x2= 100 - x1 = 100 - 73 = 27 % A1x1 + A2x2 63 .73 + A2.27 A= à = 63,64 100 100 à 4599 + 27A2 = 6364 à 27A2 = 6364 - 4599 = 1765à A2 = 65 1,0 đ 1,0 ñ Câu 4: (2,0 ñieåm ). a) %R = 100 – 8,82 = 91,18 % R2O5 à Công thức hợp chất với hidro là : RH3 MR 3.MH MR 3 = à = à MR = 31 ( P ) %R %H 91,18 8,82 b) MP =AP = Z + N = 31 Mà : N = Z + 1 à Z + Z + 1 = 31 à 2Z = 30 à Z = 15 Z= 15 : 1s22s22p63s23p3 à có tính phi kim vì có 5 electron ở lớp ngoài cùng 1,0 ñ 0,5 ñ 0,5 ñ
Tài liệu đính kèm:
 de_kiem_tra_ki_i_lop_10_mon_hoa_co_ban.doc
de_kiem_tra_ki_i_lop_10_mon_hoa_co_ban.doc





