Đề kiểm tra học kì II - Môn: Hóa học 10 - Mã đề thi 132
Câu 1: Hidro sunfua có tính chất hoá học đặc trưng là
A. Vừa có tính oxi hoá vừa có tính khử B. Tính axit
C. Tính khử D. Tính oxi hoá
Câu 2: Khi cho 15,8 gam kali permanganat (KMnO4) tác dụng với axit clohiđric đậm đặc thì thể tích khí clo (đktc) thu được là
A. 8,4 lít. B. 5,6 lít. C. 5,0 lít. D. 11,2 lít.
Câu 3: Cho 6 gam kẽm vào một cốc đựng dd H2SO44M dư .Tốc độ phản ứng thay đổi như thế nào nếu thay 6 gam kẽm hạt bằng 6 gam kẽm bột
A. Tăng rồi giảm B. Giảm C. Không thay đổi D. Tăng
Câu 4: Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là:
A. Ozon B. Cacbon đioxit C. Clo D. Oxi
Câu 5: Hoà tan hoàn toàn 5,6 lít khí SO2 (đktc) vào 100ml dung dịch KOH 3,5M. Muối tạo thành sau phản ứng là
A. K2SO3. B. KHSO3. C. K2SO3 và KHSO3. D. K
Câu 6: Cho phản ứng SO2 + Cl2 + 2H2O → H2SO4 + 2HCl. Điều nào sau đây đúng khi nói về số oxi hoá của lưu huỳnh ?
A. Không thay đổi B. Tăng từ +2 lên +4
C. Giảm từ +4 xuống +2 D. Tăng từ +4 lên +6
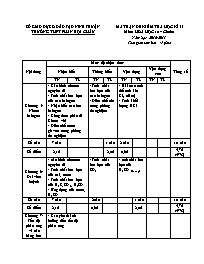
SỞ GIÁO DỤC & ĐÀO TẠO NINH THUẬN TRƯỜNG THPT PHAN BỘI CHÂU MA TRẬN ĐỀ KIỂM TRA HỌC KÌ II Môn: HÓA HỌC 10 – Chuẩn Năm học: 2016-2017 Thời gian làm bài: 45 phút Nội dung Mức độ nhận thức Tổng số Nhận biết Thông hiếu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL Chương 5: Nhóm halogen - Cấu hình eletron nguyên tử - Tính chất hóa học của các halogen - Nhận biết các ion halogen - Công thức phân tử Clorua vôi - Điều chế nước giaven trong phòng thí nghiệm - Tính chất hóa học của các halogen - Điều chế clo trong phòng thí nghiệm - Bài toán tính thể tích khí Cl2 (đktc) - Tính khối lượng HCl Số câu 7 câu 1 câu 2 câu 10 câu Số điểm 2,1đ 2,0đ 0,6đ 4,7đ (47%) Chương 6: Oxi –lưu huỳnh - cấu hình electron nguyên tử - Tính chất hóa học của oxi, ozon - Tính chất hóa học của H2S, SO2, H2SO4 - Ứng dụng của ozon, H2SO4 - Tính chất hóa học của SO2 - tính chất hóa học của H2SO4(loãng) Số câu 7 câu 2câu 1 câu 10 câu Số điểm 2,1đ 0,6đ 2,0đ 4,7đ (47%) Chương 7: Tốc độ phản ứng và cân bằng hóa học - Các yếu tố ảnh hưởng đến tốc độ phản ứng Số câu 2 câu 2 câu Số điểm 0,6đ 0,6đ (6%) Tổng số câu 16 câu 2 câu 1 câu 2 câu 1 câu 22 câu Tổng số điểm 4,8đ (48%) 0,6đ (6%) 2,0đ (20%) 0,6đ (6%) 2,0đ (20%) 10,0đ (100%) SỞ GIÁO DỤC & ĐÀO TẠO NINH THUẬN TRƯỜNG THPT PHAN BỘI CHÂU ĐỀ KIỂM TRA HỌC KÌ II Môn: HÓA HỌC 10 – Chuẩn Năm học: 2016-2017 Thời gian làm bài: 45 phút Mã đề thi 132 (Học sinh không được sử dụng tài liệu) Họ và tên học sinh:..................................................................... lớp: ............................. (Cho: K=39, Mn=55, Cl=35,5, Mg=24, Al=27, S=32, O=16, Na=23, H=1) A/ TRẮC NGHIỆM: (6,0đ) Câu 1: Hidro sunfua có tính chất hoá học đặc trưng là A. Vừa có tính oxi hoá vừa có tính khử B. Tính axit C. Tính khử D. Tính oxi hoá Câu 2: Khi cho 15,8 gam kali permanganat (KMnO4) tác dụng với axit clohiđric đậm đặc thì thể tích khí clo (đktc) thu được là A. 8,4 lít. B. 5,6 lít. C. 5,0 lít. D. 11,2 lít. Câu 3: Cho 6 gam kẽm vào một cốc đựng dd H2SO44M dư .Tốc độ phản ứng thay đổi như thế nào nếu thay 6 gam kẽm hạt bằng 6 gam kẽm bột A. Tăng rồi giảm B. Giảm C. Không thay đổi D. Tăng Câu 4: Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là: A. Ozon B. Cacbon đioxit C. Clo D. Oxi Câu 5: Hoà tan hoàn toàn 5,6 lít khí SO2 (đktc) vào 100ml dung dịch KOH 3,5M. Muối tạo thành sau phản ứng là A. K2SO3. B. KHSO3. C. K2SO3 và KHSO3. D. K Câu 6: Cho phản ứng SO2 + Cl2 + 2H2O → H2SO4 + 2HCl. Điều nào sau đây đúng khi nói về số oxi hoá của lưu huỳnh ? A. Không thay đổi B. Tăng từ +2 lên +4 C. Giảm từ +4 xuống +2 D. Tăng từ +4 lên +6 Câu 7: Yếu tố nào không làm ảnh hưởng tới tốc độ phản ứng: A. Nhiệt độ B. Nồng độ C. Áp suất D. Khối lượng Câu 8: Các nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là A. 3s2 3p5 B. ns2 np5 C. 4s2 4p5 D. 2s2 2p5 Câu 9: Thuốc thử để phân biệt được cả 4 lọ mất nhãn: KF, KCl, KBr, KI là A. Quỳ tím B. AgNO3 C. NaOH D. Cu Câu 10: Phương trình nào sau đây chứng minh tính oxi hoá của ozon mạnh hơn oxi? A. O3 + Mg →MgO + O2 B. O3 + 2Ag →Ag2O + O2 C. O2 + 4Ag →2Ag2O D. O2 + 2Mg →2MgO Câu 11: Oxi tác dụng được với các chất nào dưới đây? A. Mg, S B. Na, Cl2 C. Mg, Ag D. Ca, Au Câu 12: Đơn chất halogen có tính oxi hóa yếu nhất là A. I2 B. F2 C. Br2 D. Cl2 Câu 13: Công thức phân tử của Clorua vôi là A. CaOCl2 B. CaOCl C. CaCl2 D. CaClO2 Câu 14: Mệnh đề nào sau đây diễn tả đúng về các halogen? A. Các halogen đều có số oxi hóa dương B. Các halogen đều tan nhiều trong nước. C. Các halogen đều tác dụng được với hidro ở điều kiện thường D. Halogen đứng trước thì đẩy được halogen đứng sau ra khỏi dung dịch muối. Câu 15: Tính chất nào sau đây không phải là tính chất của Flo: A. Là phi kim có tính oxi hoá mạnh nhất B. Tác dụng được với hidro ở nhiệt độ cao,có mặt chất xúc tác C. Hợp chất của flo có trong men răng D. Chất khí màu lục nhạt,rất độc Câu 16: Cho phản ứng: aSO2 + bKMnO4 + cH2O → dK2SO4 + eMnSO4 + fH2SO4 . Với a, b, c, d, e,f là hệ số cân bằng ( tối giản ) của phản ứng.Tổng các hệ số cân bằng của phản ứng là A. 14 B. 13 C. 12 D. 15 Câu 17: Cấu hình electron của ion là A. 1s22s22p63s23p64s2 B. 1s22s22p63s23p2 C. 1s22s22p63s23p6 D. 1s22s22p63s23p4 Câu 18: Phương trình điều chế nước Giaven trong phòng thí nghiệm: A. Cl2 + 2NaOH → 2NaCl + H2O + 1/2O2 B. Cl2 + NaOH→ NaCl + HClO C. Cl2 + 2NaOH → NaCl + NaClO + H2O D. Cl2 + 2NaOH → 2NaClO + H2 Câu 19: Khẳng định không đúng về H2SO4 đặc là A. Có tính oxi hoá rất mạnh B. Dùng để chế tạo phân bón,thuốc trừ sâu, chất tẩy rửa... C. Khi tiếp xúc với da thịt làm bỏng da rất nặng D. Không có tính háo nước Câu 20: Để trung hoà m gam HCl cần dùng 100ml dung dịch NaOH 1M. Giá trị của m là A. 73 gam. B. 36,5 gam. C. 3,65 gam. D. 7,3 gam. B/ TỰ LUẬN: (4,0đ) Mã đề: 132, 357 Câu 1: (2,0đ) Hoàn thành dãy chuyển hóa sau ( ghi rõ điều kiện nếu có): KMnO4 Cl2 HCl AgCl ↓(4) HClO Câu 2: (2,0đ) Cho 15,6g hỗn hợp 2 kim loại Mg và Al tác dụng với dung dịch H2SO4 loãng, dư. Sau khi phản ứng kết thúc thu được 17,92(l) khí (đktc) a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu? b/ Tính thể tích dung dịch H2SO4 1M đã tham gia phản ứng? Mã đề: 209, 485 Câu 1: (2,0đ) Hoàn thành dãy chuyển hóa sau ( ghi rõ điều kiện nếu có): MnO2 Cl2 HCl AgCl ↓(4) HClO Câu 2: (2,0đ) Cho 15,6g hỗn hợp 2 kim loại Mg và Al tác dụng với dung dịch H2SO4 loãng, dư. Sau khi phản ứng kết thúc thu được 17,92(l) khí (đktc) a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu? b/ Tính thể tích dung dịch H2SO4 1M đã tham gia phản ứng? --- ----------- HẾT ---------- ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ II Năm học: 2016 – 2017 Môn : Hóa học 10 – chuẩn Mã đề: 132 A/ TRẮC NGHIỆM (6,0đ): Mỗi câu chọn đúng được 0,3đ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 A B C D B/ TỰ LUẬN (4,0đ) Mã đề: 132, 357 Câu Đáp án Điểm 1 (1) 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O (2) H2 + Cl2 2HCl (3) HCl + AgNO3 → AgCl↓ + HNO3 (4) Cl2 + H2O ↔ HClO + HCl 2,0đ 0,5đ 0,5đ 0,5đ 0,5đ 2 a/ Ta có: nH2 = 17,92/22,4 = 0,8mol Gọi x, y lần lượt là số mol của Mg, Al: Pt: Mg + H2SO4 → MgSO4 + H2 (1) 1 1 1 (mol) x x x (mol) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (2) 2 3 3 (mol) y 1,5y 1,5y (mol) từ (1) và (2) ta có pt: 24x + 27y = 15,6 (3) x + 1,5y = 0,8 (4) từ pt (3), (4) ta được: x =0,2; y = 0,4 => mMg = 0,2.24 = 4,8g ; mAl = 0,4.27 = 10,8g b/ ta có: nH2SO4 = 0,2 + 0,6 = 0,8mol => VH2SO4 = 0,8/1 = 0,8 lít = 800ml 2,0đ 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ 0,25đ 0,25đ Mã đề: 209, 485 Câu Đáp án Điểm 1 (1) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (2) H2 + Cl2 2HCl (3) HCl + AgNO3 → AgCl↓ + HNO3 (4) Cl2 + H2O ↔ HClO + HCl 2,0đ 0,5đ 0,5đ 0,5đ 0,5đ 2 a/ Ta có: nH2 = 17,92/22,4 = 0,8mol Gọi x, y lần lượt là số mol của Mg, Al: Pt: Mg + H2SO4 → MgSO4 + H2 (1) 1 1 1 (mol) x x x (mol) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (2) 2 3 3 (mol) y 1,5y 1,5y (mol) từ (1) và (2) ta có pt: 24x + 27y = 15,6 (3) x + 1,5y = 0,8 (4) từ pt (3), (4) ta được: x =0,2; y = 0,4 => mMg = 0,2.24 = 4,8g ; mAl = 0,4.27 = 10,8g b/ ta có: nH2SO4 = 0,2 + 0,6 = 0,8mol => VH2SO4 = 0,8/1 = 0,8 lít = 800ml 2,0đ 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ 0,25đ 0,25đ
Tài liệu đính kèm:
 de_kiem_tra_hoc_ki_ii_mon_hoa_hoc_10_ma_de_thi_132.doc
de_kiem_tra_hoc_ki_ii_mon_hoa_hoc_10_ma_de_thi_132.doc





