Đề kiểm tra học kì I - Lớp 10 - Môn kiểm tra: Hóa học
Câu 1: Nguyên tố Y thuộc chu kì 4, nhóm IIA trong bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố Y là:
A. 1s22s22p63s23p43d24s2 B. 1s22s22p63s23d64s2.
C. 1s22s22p63s23p63d2. D. 1s22s22p63s23p64s2
Câu 2: Số electron tối đa trong các lớp L, M lần lượt là:
A. 8 và 10 B. 8 và 18 C. 18 và 8 D. 18 và 10
Câu 3: Các phát biểu về các nguyên tố nhóm IA như sau: 1/ Gọi là nhóm kim loại kiềm,
2/ Có 1 electron hóa trị, 3/ Dễ nhận 1 electron. Những phát biểu đúng là:
A. 2 và 3. B. 1 và 3. C. 1,2 và 3. D. 1 và 2.
Câu 4: Phát biểu nào sau đây là đúng:
A. Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một cặp e chung.
B. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa nguyên tử kim loại với phi kim.
C. Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp e chung bị lệch về phía 1 nguyên tử.
D. Liên kết cộng hóa trị không cực là kiên kết giữa 2 nguyên tử của các nguyên tố phi kim.
Câu 5: Nguyên tố R thuộc chu kì 3, nhóm VIA trong bảng tuần hoàn. Công thức oxit cao nhất và công thức hợp chất khí với hiđro của R có dạng:
A. R2O5 và RH3 B. RO2 và RH4 C. RO3 và H2R D. R2O7 và HR
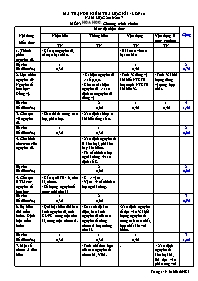
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I - LỚP 10 NĂM HỌC 2016-2017 MÔN: HOÙA HOÏC. Chương trình chuẩn Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TN TN TN 1. Thành phần nguyên tử. - Cấu tạo nguyên tử, cấu tạo hạt nhân. - Bài toán về các hạt cơ bản Số câu Số điểm(%) 1 0,3đ 1 0,4đ 2 0,7đ 2. Hạt nhân nguyên tử- Nguyên tố hóa học- Đồng vị. - Kí hiệu nguyên tử => số p,e,n. - Cho các kí hiệu nguyên tử => xác định các nguyên tử đồng vị - Tính % đồng vị khi biết NTKTB hoặc tính NTKTB khi biết %. - Tính % khối lượng đồng vị trong hợp chất. Số câu Số điểm(%) 2 0,6đ 1 0,4đ 1 0,4đ 4 1,4đ 3. Cấu tạo vỏ nguyên tử. - Số e tối đa trong các lớp, phân lớp. - Xác định số lớp e khi biết tổng số e. Số câu Số điểm(%) 1 0,3đ 1 0,3đ 2 0,6đ 4. Cấu hình electron của nguyên tử. - Xác định nguyên tố là kim loại, phi kim hay khí hiếm. - Từ cấu hình e lớp ngoài cùng à xác định số Z. Số câu Số điểm(%) 2 0,6đ 2 0,6đ 5. Cấu tạo BTH các nguyên tố hoá học - Cấu tạo BTH: ô, chu kì, nhóm. - Số lượng nguyên tố trong mỗi chu kì - Z => vị trí - Vị trí à cấu hình e lớp ngoài cùng. Số câu Số điểm(%) 1 0,3đ 2 0,6đ 3 0,9đ 6. Sự biến đổi tuần hoàn. Định luật tuần hoàn - Qui luật biến đổi bán kính nguyên tử, tính KL-PK trong một chu kì, trong một nhóm A. - So sánh độ âm điện, bán kính nguyên tử của các nguyên tố cùng nhóm A hoặc cùng chu kì. -Xác định nguyên tố dựa vào % khối lượng nguyên tố trong oxit cao nhất, hợp chất khí với hidro. Số câu Số điểm(%) 1 0,3đ 1 0,3đ 1 0,4đ 3 1,0đ 7. Một số nhóm A tiêu biểu - Tính chất hóa học của các nguyên tố nhóm IA, VIIA. . - Xác định nguyên tố kim loại IA, IIA dựa vào phản ứng với nước. - Cho hỗn hợp kim loại kiềm, kiềm thổ tác dụng với nước. Tính phần trăm khối lượng. Số câu Số điểm(%) 1 0,3đ 2 0,8đ 3 1,1đ 8.Ý nghĩa của BTH các nguyên tố hoá học - Từ vị trí nhóm A suy ra CT oxit cao nhất, CT hợp chất với hidro, CT hiđroxit tương ứng. Số câu Số điểm(%) 1 0,3đ 2 0,7đ 9. Liên kết ion - Xác định công thức hợp chất ion tạo thành giữa các nguyên tố. - Xác định số e, p có trong ion đơn hoặc đa nguyên tử. Số câu Số điểm(%) 1 0,3đ 1 0,4đ 2 0,7đ 10. Liên kết cộng hóa trị Khái niệm liên kết CHT có cực, không có cực. - Công thức cấu tạo một số hợp chất đơn giản. - Tính hiệu độ âm điện và xác định loại liên kết trong hợp chất. Số câu Số điểm(%) 1 0,3đ 1 0,3đ 1 0,4đ 3 1,0đ 11. Hóa trị và số oxi hóa - Xác định điện hóa trị trong hợp chất ion. - Xác định số oxi hóa của nguyên tử trong hợp chất. Số câu Số điểm(%) 2 0,6đ 2 0,6đ 12. Phản ứng oxi hóa- khử - Cho phản ứng oxi hóa – khử à tìm chất khử và chất oxi hóa. - Viết quá trình oxi hóa- quá trình khử. - Lập phương trình phản ứng oxi hóa - khử Số câu Số điểm(%) 1 0,3đ 2 0,8đ 3 1,1đ Tổng số câu Tổng số điểm 5 1,5đ 15 4,5đ 7 2,8đ 3 1,2đ 30 10,0đ Mã đề 485 Họ, tên học sinh: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lớp: . . . . . . . . . . . SỞ GD-ĐT NINH THUẬN Trường THPT Trường Chinh ********* (đề kiểm tra có 2 trang) ĐỀ KIỂM TRA HỌC KÌ I - LỚP 10 NĂM HỌC 2016-2017 MÔN: HOÙA HOÏC. Chương trình chuẩn Thời gian làm bài: 45 phút (không kể thời gian phát đề) Câu 1: Nguyên tố Y thuộc chu kì 4, nhóm IIA trong bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố Y là: A. 1s22s22p63s23p43d24s2 B. 1s22s22p63s23d64s2. C. 1s22s22p63s23p63d2. D. 1s22s22p63s23p64s2 Câu 2: Số electron tối đa trong các lớp L, M lần lượt là: A. 8 và 10 B. 8 và 18 C. 18 và 8 D. 18 và 10 Câu 3: Các phát biểu về các nguyên tố nhóm IA như sau: 1/ Gọi là nhóm kim loại kiềm, 2/ Có 1 electron hóa trị, 3/ Dễ nhận 1 electron. Những phát biểu đúng là: A. 2 và 3. B. 1 và 3. C. 1,2 và 3. D. 1 và 2. Câu 4: Phát biểu nào sau đây là đúng: A. Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một cặp e chung. B. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa nguyên tử kim loại với phi kim. C. Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp e chung bị lệch về phía 1 nguyên tử. D. Liên kết cộng hóa trị không cực là kiên kết giữa 2 nguyên tử của các nguyên tố phi kim. Câu 5: Nguyên tố R thuộc chu kì 3, nhóm VIA trong bảng tuần hoàn. Công thức oxit cao nhất và công thức hợp chất khí với hiđro của R có dạng: A. R2O5 và RH3 B. RO2 và RH4 C. RO3 và H2R D. R2O7 và HR Câu 6: Số thứ tự của nhóm A cho biết: A. số electron hoá trị của nguyên tử. B. số lớp electron của nguyên tử. C. số electron trong nguyên tử. D. số hiệu nguyên tử. Câu 7: Nguyên tử X có 13 proton và nguyên tử Y có 8 electron. Hợp chất hình thành giữa 2 nguyên tố này và loại liên kết có thể là: A. XY với liên kết cộng hóa trị. B. X2Y3 với liên kết ion. C. X2Y3 với liên kết cộng hóa trị. D. X3Y2 với liên kết ion. Câu 8: Điều nào sau đây sai khi nói về bảng hệ thống tuần hoàn ? A. Trong cùng một chu kì, độ âm điện thường giảm từ trái sang phải. B. Nguyên tố nào ở chu kì 4 phải có 4 lớp electron. C. Trong cùng một nhóm A, bán kính nguyên tử thường tăng từ trên xuống dưới. D. Các nguyên tố trong nhóm II A đều có 2 electron ở lớp ngoài cùng. Câu 9: Theo quy tắc bát tử thì công thức cấu tạo của phân tử CO2 là: A. O − C − O B. O = C ® O C. O = C − O D. O = C = O Câu 10: Cho phản ứng oxh - khử sau: . Chất khử và chất oxi hóa lần lượt là: A. NO và H2O B. O2 và NH3 C. NH3 và NO. D. NH3 và O2 Câu 11: Hạt nhân của hầu hết các nguyên tử do các loại hạt nào cấu tạo nên ? A. electron và proton B. electron và nơtron C. electron, proton và nơtron D. proton và nơtron Câu 12: Điện hóa trị của các nguyên tố O, S ( thuộc nhóm VIA) trong các hợp chất với các nguyên tố nhóm IA đều là: A. 1–. B. 2+ C. 2– D. 3+ Câu 13: Nguyên tử K(Z=19) có số lớp electron là: A. 4 B. 3 C. 2 D. 1 Câu 14: Dãy hai nguyên tử nào dưới đây là hai đồng vị của cùng một nguyên tố hóa học? A. B. C. D. Câu 15: Nguyên tử của nguyên tố nào sau đây trong hạt nhân có chứa 19 proton và 20 nơtron? A. Ca B. K C. Sc D. K Câu 16: Nguyên tố X có Z = 16, vị trí của X trong bảng tuần hoàn là: A. chu kì 3, nhóm VIB B. chu kì 3, nhóm VIIIA C. chu kì 3, nhóm VIIIB D. chu kì 3, nhóm VIA Câu 17: Nguyên tử của nguyên tố Y có cấu hình electron ở phân lớp ngoài cùng là 3p6. Số hiệu nguyên tử của Y là: A. 20 B. 18 C. 6 D. 16 Câu 18: Số oxi hóa của kim loại Mn, nguyên tố Fe trong FeCl3, nguyên tố S trong SO3, nguyên tố P trong PO43– lần lượt là: A. 0, +3 , +5 , +6. B. 0, +3 , +6 , +5. C. +5 , +6 , +3 , 0. D. +3 , +5 , 0 , +6. Câu 19: Độ âm điện của các nguyên tố: Na, Mg, Al, Si xếp theo chiều tăng dần là: A. Si < Mg < Al < Na B. Na < Mg < Al < Si C. Si < Al < Mg < Na D. Al < Na < Si < Mg Câu 20: Cho biết cấu hình electron nguyên tử của các nguyên tố sau: X là 1s2 2s2 2p4; Y là 1s2 2s2 2p6; Z là 1s2 2s2 2p6 3s2; T là 1s2 2s2 2p6 3s2 3p3; Q là 1s2 2s2 2p6 3s2 3p5; R là 1s2 2s2 2p6 3s2 3p6. Các nguyên tố phi kim là: A. Y, Z, T. B. X, T, Q. C. T, Q, R. D. X, Y, T. Câu 21: Cho độ âm điện: Cs=0,79; Ba=0,89; Cl= 3,16; H= 2,2; S= 2,58; F= 3,98; để xác định loại liên kết trong các phân tử sau: H2S, CsCl, HCl, BaF2. Phân tử có liên kết cộng hóa trị không phân cực là: A. BaF2 B. CsCl C. H2S. D. HCl Câu 22: Cho 17,6 gam hỗn hợp 2 kim loại K và Ba tác dụng hết với nước dư thu được 3,36 lít khí H2 (đktc). Thành phần % về khối lượng mỗi kim loại trong hỗn hợp đầu là: (Cho K = 39, Ba = 137). A. 21,7% và 78,3% B. 22,16% và 77,84% C. 30% và 70%. D. 43,4% và 56,6% Câu 23: Cho phản ứng oxi hóa – khử sau: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Tổng các hệ số cân bằng (tối giản) trong phản ứng trên là: A. 20 B. 10 C. 12 D. 18 Câu 24: Cho 10 gam một kim loại có hóa trị II tác dụng hết với nước thu được 5,6 lít khí H2 (đktc). Kim loại đó là: (Cho Be = 9; Mg =24; Ca =40; Ba =137). A. Ca B. Be C. Ba D. Mg Câu 25: Hợp chất khí với hidro của nguyên tố R có công thức RH4, trong oxit cao nhất thì oxi chiếm 72,73% theo khối lượng. Vậy R là: A. 73Ge B. 28Si C. 12C D. 119Sn Câu 26: Cho phản ứng oxi hóa – khử sau: Fe + CuSO4 → FeSO4 + Cu. Quá trình oxi hóa trong phản ứng này là: A. B. C. D. Câu 27: Trong tự nhiên Clo có 2 đồng vị và . Nguyên tử khối trung bình của Clo là 35,5. Phần trăm về khối lượng của trong HClO là: (cho ) A. 48,67%. B. 50,00%. C. 51,23%. D. 55,20% Câu 28: Bo trong thiên nhiên là hỗn hợp gồm hai đồng vị là và (trong đó chiếm 18,89% về số nguyên tử). Nguyên tử khối trung bình của nguyên tố Bo là: A. 10,62 B. 10,21 C. 10,81 D. 10,32 Câu 29: Số electron lần lượt có trong ion đơn và đa nguyên tử là: (Cho 20Ca, 15P, 8O) A. 18 và 50----------------B. 20 và 47 C. 20 và 50 D. 18 và 47 Câu 30: Tổng số hạt cơ bản trong phân tử X có công thức là M2O là 140, trong phân tử X thì tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Vậy M là: (cho) A. K (Z=19) B. Al (Z=13) C. Cl (Z=17) D. ----------- HẾT ---------- SỞ GD-ĐT NINH THUẬN Trường THPT Trường Chinh ********* ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ I - LỚP 10 NĂM HỌC 2016-2017 MÔN: HOÙA HOÏC. Chương trình chuẩn ĐÁP ÁN, HƯỚNG DẪN CHẤM VÀ BIỂU ĐIỂM Câu 132 209 357 485 Điểm 1 B B B D 0,3đ 2 D D D B 0,3đ 3 B B C D 0,3đ 4 B A D C 0,3đ 5 B C B C 0,3đ 6 D C B A 0,3đ 7 D C D B 0,3đ 8 A D B A 0,3đ 9 C B A D 0,3đ 10 C A A D 0,3đ 11 A C B D 0,3đ 12 C C A C 0,3đ 13 C A D A 0,3đ 14 A D B D 0,3đ 15 D D D B 0,3đ 16 D D C D 0,3đ 17 D B A B 0,3đ 18 A B B B 0,3đ 19 A B B B 0,3đ 20 C C C B 0,3đ 21 C D A C 0,4đ 22 A C A B 0,4đ 23 C C C A 0,4đ 24 B C D A 0,4đ 25 C A A C 0,4đ 26 B A C B 0,4đ 27 A D C B 0,4đ 28 D B A C 0,4đ 29 A B B A 0,4đ 30 C C C A 0,4đ
Tài liệu đính kèm:
 de_kiem_tra_hoc_ki_i_lop_10_mon_kiem_tra_hoa_hoc.doc
de_kiem_tra_hoc_ki_i_lop_10_mon_kiem_tra_hoa_hoc.doc





