Đề kiểm tra 1 tiết lần 4 - Môn: Hóa học 10
Câu 1: Công thức của oleum là
A. H2SO3.SO3 B. H2SO4.SO4 C. H2SO4.nSO3 D. H2SO3.nSO3
Câu 2: Các số oxi hóa của lưu huỳnh là
A. -4, -2, 0, +4, +6 B. -2, 0, +4, +6 C. -4, 0, +2, +4 D. -3, 0, +3, +5
Câu 3: Hấp thụ hoàn toàn 12,8g SO2 vào 400ml dung dịch NaOH 1M. Biết sau phản ứng chỉ tạo ra muối trung hòa với khối lượng là
A. 25,2g B. 20,8g C. 41,6g D. 50,4g
Câu 4: Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ khí thải nhà máy có khí
A. SO2 B. CO2 C. H2S D. NH3
Câu 5: Để pha loãng dung dịch H2SO4(đ), ta nên
A. Rót từ từ nước vào dung dịch H2SO4(đ)
B. Rót từ từ dung dịch H2SO4(đ) vào nước
C. Rót nước thật nhanh vào dung dịch H2SO4(đ)
D. Rót nhanh dung dịch H2SO4(đ) vào nước
Câu 6: Có 3 lọ mất nhãn đựng: HCl, BaCl2, H2SO4. Thuốc thử dùng để phân biệt 3 lọ trên là
A. Quỳ tím B. Dung dịch NaCl
C. Dung dịch AgNO3 D. Dung dịch Ba(NO3)2
Câu 7: Cho 9,6g Cu phản ứng hoàn toàn với dung dịch H2SO4(đ,nóng) dư, sau phản ứng thu được V(l) khí SO2(đktc, sản phẩm khử duy nhất). Giá trị V là
A. 1,12(l) B. 2,24(l) C. 3,36(l) D. 4,48(l)
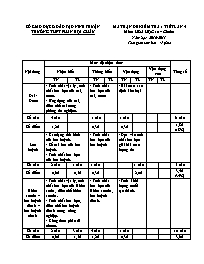
SỞ GIÁO DỤC & ĐÀO TẠO NINH THUẬN TRƯỜNG THPT PHAN BỘI CHÂU MA TRẬN ĐỀ KIỂM TRA 1 TIẾT LẦN 4 Môn: HÓA HỌC 10 – Chuẩn Năm học: 2016-2017 Thời gian làm bài: 45 phút Nội dung Mức độ nhận thức Tổng số Nhận biết Thông hiếu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL Oxi - Ozon - Tính chất vật lý , tính chất hóa học của oxi, ozon. - Ứng dụng của oxi, điều chế oxi trong phòng thí nghiệm. - Tính chất hóa học của oxi, ozon - Bài toán xác định kim loại Số câu 4 câu 1 câu 1 câu 6 câu Số điểm 1,2đ 0,3đ 0,3đ 1,8đ (18%) Lưu huỳnh - Các dạng thù hình của lưu huỳnh. - Số oxi hóa của lưu huỳnh. - Tính chất hóa học của lưu huỳnh. - Tính chất hóa học của lưu huỳnh - Dựa vào tính chất hóa học giải bài toán lượng dư Số câu 2 câu 1 câu 1 câu 1 câu 5 câu Số điểm 0,6đ 0,5đ 0,3đ 2,0đ 3,4đ (34%) Hidro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit - Tính chất vật lý, tính chất hóa học của Hidro sufua, điều chế hidro sunfua. - Tính chất hóa học, điều chế lưu huỳnh đioxit trong công nghiệp. - Công thức phân tử oleum. - Tính chất hóa học của Hidro sunfua, lưu huỳnh đioxit. - Tính khối lượng muối tạo thành. Số câu 2 câu 3 câu 4 câu 1 câu 10 câu Số điểm 0,6đ 1,5đ 1,2đ 0,3đ 3,6đ (36%) Axit sunfuric – muối sunfat - Tính chất vật lý, tính chất hóa học của axit sunfuric - bài toán tính theo phương trình hóa học - Nhận biết ion sunfat Số câu 2 câu 2 câu 4 câu Số điểm 0,6đ 0,6đ 1,2đ (12%) Tổng số câu 10 câu 4 câu 6 câu 4 câu 1 câu 25 câu Tổng số điểm 3,0đ (30%) 2,0đ (20%) 1,8đ (18%) 1,2đ (12%) 2,0đ (20%) 10,0đ (100%) SỞ GIÁO DỤC & ĐÀO TẠO NINH THUẬN TRƯỜNG THPT PHAN BỘI CHÂU ĐỀ KIỂM TRA 1 TIẾT LẦN 4 Môn: HÓA HỌC 10 – Chuẩn Năm học: 2016-2017 Thời gian làm bài: 45 phút Mã đề thi 132 (Học sinh không được sử dụng tài liệu) Họ và tên học sinh:..................................................................... lớp: ............................. (Cho: Zn=65, Fe=56, Ca=40, Cu=64, O=16, S=32, Na=23, H=1, Cl=35,5) A/ TRẮC NGHIỆM: (6,0 đ) Câu 1: Công thức của oleum là A. H2SO3.SO3 B. H2SO4.SO4 C. H2SO4.nSO3 D. H2SO3.nSO3 Câu 2: Các số oxi hóa của lưu huỳnh là A. -4, -2, 0, +4, +6 B. -2, 0, +4, +6 C. -4, 0, +2, +4 D. -3, 0, +3, +5 Câu 3: Hấp thụ hoàn toàn 12,8g SO2 vào 400ml dung dịch NaOH 1M. Biết sau phản ứng chỉ tạo ra muối trung hòa với khối lượng là A. 25,2g B. 20,8g C. 41,6g D. 50,4g Câu 4: Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ khí thải nhà máy có khí A. SO2 B. CO2 C. H2S D. NH3 Câu 5: Để pha loãng dung dịch H2SO4(đ), ta nên A. Rót từ từ nước vào dung dịch H2SO4(đ) B. Rót từ từ dung dịch H2SO4(đ) vào nước C. Rót nước thật nhanh vào dung dịch H2SO4(đ) D. Rót nhanh dung dịch H2SO4(đ) vào nước Câu 6: Có 3 lọ mất nhãn đựng: HCl, BaCl2, H2SO4. Thuốc thử dùng để phân biệt 3 lọ trên là A. Quỳ tím B. Dung dịch NaCl C. Dung dịch AgNO3 D. Dung dịch Ba(NO3)2 Câu 7: Cho 9,6g Cu phản ứng hoàn toàn với dung dịch H2SO4(đ,nóng) dư, sau phản ứng thu được V(l) khí SO2(đktc, sản phẩm khử duy nhất). Giá trị V là A. 1,12(l) B. 2,24(l) C. 3,36(l) D. 4,48(l) Câu 8: Tính chất không đúng về oxi là A. Oxi tan nhiều trong nước B. Khí oxi duy trì sự cháy C. Khí oxi nặng hơn không khí D. Oxi là chất khí không màu, không mùi Câu 9: Trong các câu sau, câu nào đúng khi nói về ozon? A. Ozon không oxi hóa được Ag B. Ozon có tính oxi hóa yếu hơn oxi C. Ozon oxi hóa tất cả các kim loại D. Ozon là dạng thù hình của oxi Câu 10: Khí có mùi trứng thối là A. SO2 B. O2 C. H2S D. CO2 Câu 11: SO2 vừa có tính khử, vừa có tính oxi hóa là vì A. Phân tử SO2 không bền B. Trong phân tử SO2, nguyên tử S còn có 1 đôi electron tự do C. Trong phân tử SO2, nguyên tử S có mức oxi hóa trung gian D. Phân tử SO2 dễ bị oxi hóa Câu 12: Trong phòng thí nghiệm, người ta điều chế oxi bằng cách: A. Điện phân nước B. Nhiệt phân K2MnO4 C. Chưng cất phân đoạn không khí lỏng D. Nhiệt phân KClO3, xúc tác MnO2 Câu 13: Trong công nghiệp, oxi ứng dụng nhiều nhất trong ngành: A. Y khoa B. Thuốc nổ nhiên liệu tên lửa C. Hàn cắt kim loại D. Luyện thép Câu 14: Đốt 13g bột một kim loại R (II) trong oxi dư đến khối lượng không đổi, sau phản ứng thu được chất rắn X có khối lượng 16,2g. R là A. Fe B. Zn C. Ca D. Cu Câu 15: Dãy chất chỉ thể hiện tính oxi hóa là A. F2, O2, O3 B. Br2, Cl2, F2 C. H2S, SO2, O2 D. O3, O2, Cl2 Câu 16: H2SO4(đ) khi tiếp xúc với đường có thể làm chúng hóa đen là do H2SO4(đ) có tính A. Oxi hóa mạnh B. Axit mạnh C. Khử mạnh D. Háo nước Câu 17: Cho phương trình: H2S(k) + O2 H2O + X (trong môi trường thiếu oxi), X là A. SO3 B. S C. H2SO4 D. SO2 Câu 18: Lưu huỳnh có mấy dạng thù hình chính? A. 1 B. 4 C. 3 D. 2 Câu 19: Khí làm mất màu dung dịch brom là A. O2 B. SO2 C. CO2 D. Cl2 Câu 20: Trong các phản ứng sau, phản ứng thể hiện tính oxi hóa của lưu huỳnh đơn chất là A. S + H2 H2S B. S + O2 SO2 C. S + 2H2SO4(đ) → 3SO2 + 2H2O D. S + 3F2 SF6 B/ TỰ LUẬN: (4,0đ) Mã đề: 132, 357 Câu 1: (2,0đ) Hoàn thành dãy chuyển hóa sau: FeS2 SO2 S H2S NaHS Câu 2: (2,0đ) Đun nóng một hỗn hợp gồm 2,8g bột Fe và 0,8g bột S trong môi trường không có không khí. Lấy sản phẩm thu được cho vào 0,02 lít dung dịch HCl vừa đủ, sau phản ứng thu được hỗn hợp khí X. a. X gồm các chất khí nào? b. Tính nồng độ mol dung dịch HCl cần dùng? Mã đề: 209, 485 Câu 1: (2,0đ) Hoàn thành dãy chuyển hóa sau: FeS H2S S SO2 K2SO3 Câu 2: (2,0đ) Đun nóng một hỗn hợp gồm 6,5g bột Zn và 1,6g bột S trong môi trường không có không khí. Lấy sản phẩm thu được cho vào 0,05 lít dung dịch HCl vừa đủ, sau phản ứng thu được hỗn hợp khí X. a. X gồm các chất khí nào? b. Tính nồng độ mol dung dịch HCl cần dùng? ----------- HẾT ---------- ĐÁP ÁN ĐỀ KIỂM TRA 1 TIẾT LẦN 4 Năm học: 2016 – 2017 Môn : Hóa học 10 – chuẩn Mã đề: 132 A/ TRẮC NGHIỆM: (6,0đ) mỗi câu đúng được 0,3đ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 A B C D 19 20 A B C D B/ TỰ LUẬN: (4,0đ) Mã đề: 132, 357 Câu Đáp án Điểm 1 (1) 4FeS2 + 11O2 2Fe2O3 + 8SO2 (2) SO2 + 2H2S → 3S + 2H2O (3) S + H2 H2S (4) H2S + NaOH → NaHS + H2O 2,0đ 0,5đ 0,5đ 0,5đ 0,5đ 2 a/ Ta có: nFe = 2,8/56 = 0,05 mol nS = 0,8/32 = 0,025 mol Pt: Fe + S FeS 0,025 0,025 0,025 (mol) => Fe dư, nFe dư = 0,05 – 0,025 = 0,025mol Pt: FeS + 2HCl → FeCl2 + H2S↑ Fe + 2HCl → FeCl2 + H2↑ Vậy khí X gồm khí H2S và khí H2 b/ pt: FeS + 2HCl → FeCl2 + H2S↑ 1 2 (mol) 0,025 0,05 (mol) Fe + 2HCl → FeCl2 + H2↑ 1 2 (mol) 0,025 0,05 (mol) => CM(HCl) = n/V = (0,05+0,05)/0,02 = 5M 2.0đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ Mã đề 209, 485 Câu Đáp án Điểm 1 (1) FeS + 2HCl → FeCl2 + H2S (2) 2H2S + O2 2S + 2H2O (3) S + O2 SO2 (4) SO2 + K2O → K2SO3 2,0đ 0,5đ 0,5đ 0,5đ 0,5đ 2 a/ Ta có: nZn = 6,5/65 = 0,1 mol nS = 1,6/32 = 0,05 mol pt: Zn + S ZnS 0,05 0,05 0,05 (mol) => Zn dư, nZn = 0,1 – 0,05 = 0,05mol Pt: ZnS + 2HCl → ZnCl2 + H2S↑ Zn + 2HCl → ZnCl2 + H2↑ Vậy X gồm khí H2S và khí H2 b/ pt: ZnS + 2HCl → ZnCl2 + H2S↑ 1 2 (mol) 0,05 0,1 (mol) Zn + 2HCl → ZnCl2 + H2↑ 1 2 (mol) 0,05 0,1 (mol) => CM(HCl) = n/V = (0,1+0,1)/0,05 = 4M 2,0đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ
Tài liệu đính kèm:
 de_kiem_tra_1_tiet_lan_4_mon_hoa_hoc_10.doc
de_kiem_tra_1_tiet_lan_4_mon_hoa_hoc_10.doc





