Đề kiểm tra 1 tiết lần 3 - Môn: Hóa học 10 (Chương trình chuyên)
Câu 1: (1 điểm)
a) Viết công thức cấu tạo của clorua vôi.
b) Viết phương trình phản ứng điều chế clorua vôi.
c) Nêu 2 ứng dụng của clorua vôi mà em biết.
Câu 2: (1 điểm) Cho dãy chất sau:
(a) Fe2O3, KMnO4, Cu; (b) Fe, CuO, Ba(OH)2;
(c) CaCO3, H2SO4, Mg(OH)2; (d) AgNO3 (dd), MgCO3, BaSO4;
- Chọn dãy gồm các chất đều tác dụng được với dung dịch HCl.
- Viết các phương trình phản ứng xảy ra.
Câu 3: (1 điểm) Viết các phương trình phản ứng xảy ra giữa các cặp chất sau:
a) NaCl (rắn) + H2SO4 đặc b) PBr3 + H2O
c) Cl2 + KOH d) SiO2 + HF
Câu 4: (1 điểm) Theo định nghĩa của Bronsted, các ion Na+, HCO , CH3COO là axit, bazơ, lưỡng tính hay trung tính? Giải thích.
Câu 5: (1 điểm) Tiến hành thí nghiệm sau: Cho vào ống nghiệm khô một ít muối kali clorat, nhỏ tiếp vào ống nghiệm vài giọt dung dịch axit clohidric đậm đặc. Đậy ống nghiệm bằng nút cao su có đính một băng giấy màu ẩm. Nêu hiện tượng quan sát được và viết phương trình hóa học của các phản ứng xảy ra.
Câu 6: (1 điểm) So sánh:
a) Tính khử của HCl và HBr.
b) Tính oxi hóa của Br2 và I2.
Viết phương trình phản ứng chứng minh.
Câu 7: (1 điểm) Tính pH của dung dịch chứa CH3COOH 0,1M và CH3COONa 0,1M.
Cho .
Câu 8: (1 điểm) Cho 69,6 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 13,44 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%.
Câu 9: (1 điểm) Một dung dịch có chứa 2 ion là Fe2+ (a mol), Al3+ (b mol) và 2 anion là Cl (0,2 mol), SO (0,3 mol). Tìm giá trị (a + b), biết rằng khi cô cạn dung dịch thu được 46,9 gam chất rắn khan.
Câu 10: (1 điểm) Hòa tan hoàn toàn 0,46 gam hỗn hợp A gồm hai kim loại kiềm bằng 200 dung dịch HCl 0,15M (dư), thu được dung dịch B chứa các chất tan có nồng độ mol bằng nhau. Xác định hai kim loại trong hỗn hợp A.
(Cho nguyên tử khối của: H = 1; N = 14; O = 16; Al = 27; S = 32; Cl = 35,5; Mn = 55; Fe = 56; và của các kim loại kiềm: Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133)
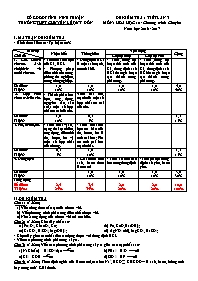
SỞ GD&ĐT TỈNH NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN ĐỀ KIỂM TRA 1 TIẾT LẦN 3 MÔN: HÓA HỌC 10 - Chương trình Chuyên Năm học 2016 - 2017 I. MA TRẬN ĐỀ KIỂM TRA - Hình thức kiểm tra: Tự luận 100% Mức độ Chủ đề Nhận biết Thông hiểu Vận dụng Cộng Cấp độ thấp Cấp độ cao 1. Clo. Hidro clorua. Axit clohidric và muối clorua. - Tính chất hóa học của Cl 2, HCl. - Phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp. - Dung dịch HCl là một axit mạnh, có tính khử. - Tính nồng độ hoặc thể tích của Cl 2, dung dịch axit HCl tham gia hoặc tạo thành trong phản ứng. - Tính nồng độ hoặc thể tích của Cl 2, dung dịch axit HCl tham gia hoặc tạo thành trong phản ứng. Số điểm: Tỉ lệ%: 1,0 10% 1,0 10% 1,0 10% 1,0 10% 4,0 40% 2. Hợp chất chứa oxi của clo. - Thành phần hóa học, ứng dụng, nguyên tắc sản xuất một số hợp chất có oxi của clo. -Tính oxi hoá mạnh của một số hợp chất có oxi của clo. Số điểm: Tỉ lệ%: 1,0 10% 0,5 5% 1,5 15% 3. Flo, brom, iot. - Tính chất vật lí, trạng thái tự nhiên, ứng dụng, điều chế flo, brom, iot và một số hợp chất của chúng. - Tính chất hoá học cơ bản của flo, brom, iot là tính oxi hoá; Flo có tính oxi hoá mạnh nhất. Số điểm: Tỉ lệ%: 0,5 5% 1,0 10% 1,5 15% 4. Dung dịch - Giải thích tính axit, bazơ theo Bronsted - Tính số mol các ion trong dung dịch - Tính pH của dung dịch axit yếu, bazơ yếu. Số điểm: Tỉ lệ%: 1,0 10% 1,0 10% 1,0 10% 3,0 30% Tổng cộng Số điểm: Tỉ lệ%: 2,5 25% 3,5 35% 2,0 20% 2,0 20% 10,0 100% II. ĐỀ KIỂM TRA Câu 1: (1 điểm) a) Viết công thức cấu tạo của clorua vôi. b) Viết phương trình phản ứng điều chế clorua vôi. c) Nêu 2 ứng dụng của clorua vôi mà em biết. Câu 2: (1 điểm) Cho dãy chất sau: (a) Fe2O3, KMnO4, Cu; (b) Fe, CuO, Ba(OH)2; (c) CaCO3, H2SO4, Mg(OH)2; (d) AgNO3 (dd), MgCO3, BaSO4; - Chọn dãy gồm các chất đều tác dụng được với dung dịch HCl. - Viết các phương trình phản ứng xảy ra. Câu 3: (1 điểm) Viết các phương trình phản ứng xảy ra giữa các cặp chất sau: a) NaCl (rắn) + H2SO4 đặc b) PBr3 + H2O c) Cl2 + KOH d) SiO2 + HF Câu 4: (1 điểm) Theo định nghĩa của Bronsted, các ion Na+, HCO, CH3COO là axit, bazơ, lưỡng tính hay trung tính? Giải thích. Câu 5: (1 điểm) Tiến hành thí nghiệm sau: Cho vào ống nghiệm khô một ít muối kali clorat, nhỏ tiếp vào ống nghiệm vài giọt dung dịch axit clohidric đậm đặc. Đậy ống nghiệm bằng nút cao su có đính một băng giấy màu ẩm. Nêu hiện tượng quan sát được và viết phương trình hóa học của các phản ứng xảy ra. Câu 6: (1 điểm) So sánh: a) Tính khử của HCl và HBr. b) Tính oxi hóa của Br2 và I2. Viết phương trình phản ứng chứng minh. Câu 7: (1 điểm) Tính pH của dung dịch chứa CH3COOH 0,1M và CH3COONa 0,1M. Cho . Câu 8: (1 điểm) Cho 69,6 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 13,44 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. Câu 9: (1 điểm) Một dung dịch có chứa 2 ion là Fe2+ (a mol), Al3+ (b mol) và 2 anion là Cl (0,2 mol), SO(0,3 mol). Tìm giá trị (a + b), biết rằng khi cô cạn dung dịch thu được 46,9 gam chất rắn khan. Câu 10: (1 điểm) Hòa tan hoàn toàn 0,46 gam hỗn hợp A gồm hai kim loại kiềm bằng 200 dung dịch HCl 0,15M (dư), thu được dung dịch B chứa các chất tan có nồng độ mol bằng nhau. Xác định hai kim loại trong hỗn hợp A. (Cho nguyên tử khối của: H = 1; N = 14; O = 16; Al = 27; S = 32; Cl = 35,5; Mn = 55; Fe = 56; và của các kim loại kiềm: Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133) ----------HẾT---------- II. ĐÁP ÁN NỘI DUNG ĐIỂM Câu 1: a) Viết công thức cấu tạo của clorua vôi. b) Viết phương trình phản ứng điều chế clorua vôi. c) Nêu 2 ứng dụng của clorua vôi mà em biết. a) CaOCl2 0,25 b) Cl2 + Ca(OH)2 CaOCl2 + H2O 0,5 c) 2 ứng dụng: - tẩy trắng sợi, vài, giấy. - xử lí các chất độc 0,25 Câu 2: Cho dãy chất sau: (a) Fe2O3, KMnO4, Cu; (b) Fe, CuO, Ba(OH)2; (c) CaCO3, H2SO4, Mg(OH)2; (d) AgNO3 (dd), MgCO3, BaSO4; - Chọn dãy gồm các chất đều tác dụng được với dung dịch HCl. - Viết các phương trình phản ứng xảy ra. - Dãy (b) 0,25 - Các PTHH: Fe + 2HCl FeCl2 + H2 0,25 CuO + 2HCl CuCl2 + H2O 0,25 Ba(OH)2 + 2HCl BaCl2 + 2H2O 0,25 Câu 3: Viết các phương trình phản ứng xảy ra giữa các cặp chất sau: a) NaCl (rắn) + H2SO4 đặc b) PBr3 + H2O c) Cl2 + KOH d) SiO2 + HF a) NaCl (rắn) + H2SO4 đặc HCl + NaHSO4 0,25 b) PBr3 + 3H2O 3HBr + H3PO3 0,25 c) 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O 0,25 d) SiO2 + 4HF SiF4 + 2H2O 0,25 Câu 4: (1 điểm) Theo định nghĩa của Bronsted, các ion Na+, HCO, CH3COO là axit, bazơ, lưỡng tính hay trung tính? Giải thích. - Ion Na+ là trung tính 0,25 - Ion HCO là lưỡng tính, vì HCO + H2O CO + H3O HCO + H2O H2CO3 + OH 0,5 - Ion CH3COOlà bazơ, vì CH3COO + H2O CH2COOH + OH 0,25 Câu 5: Tiến hành thí nghiệm sau: Cho vào ống nghiệm khô một ít muối kali clorat, nhỏ tiếp vào ống nghiệm vài giọt dung dịch axit clohidric đậm đặc. Đậy ống nghiệm bằng nút cao su có đính một băng giấy màu ẩm. Nêu hiện tượng quan sát được và viết phương trình hóa học của các phản ứng xảy ra. - Hiện tượng: + sủi bọt khí có màu vàng lục + băng giấy màu chuyển thành màu trắng 0,5 - PTHH: KClO3 + 6HCl KCl + 3Cl2 + 3H2O Cl2 + H2O HCl + HClO 0,5 Câu 6: (1 điểm) So sánh: a) Tính khử của HCl và HBr. b) Tính oxi hóa của Br2 và I2. Viết phương trình phản ứng chứng minh. a) Tính khử của HBr > HCl 0,25 - PTHH: 4HBr + O2 2H2O + 2Br2 (HCl không có phản ứng này) 0,25 b) Tính oxi hóa của Br2 > I2 0,25 - PTHH: Br2 + 2NaI I2 + 2NaBr 0,25 Câu 7: Tính pH của dung dịch chứa CH3COOH 0,1M và CH3COONa 0,1M. Cho . CH3COOH + H2O CH3COO + H3O+ [ ] 0,1 - x 0,1 + x x 0,25 Có: 0,5 Vậy pH = 0,25 Câu 8: Cho 69,6 gam MnO2 tác dụng với m gam dung dịch HCl 37% đun nóng, thu được 13,44 lít khí Cl2 (đktc). Tìm giá trị m. Cho rằng hiệu suất của phản ứng đạt được 100%. - Số mol MnO2 = 0,8 mol; Số mol Cl2 = 0,6 mol 0,25 - PTHH: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O - Nhận xét: MnO2 dư 0,25 - mol 0,25 gam 0,25 Câu 9: Một dung dịch có chứa 2 ion là Fe2+ (a mol), Al3+ (b mol) và 2 anion là Cl (0,2 mol), SO(0,3 mol). Tìm giá trị (a + b), biết rằng khi cô cạn dung dịch thu được 46,9 gam chất rắn khan. - Có: 56a + 27b + 35,5.0,2 + 96.0,3 = 46,9 hay 56a + 27b = 11 (1) 0,25 - Định luật bảo toàn điện tích: 2a + 3b = 0,2.1 + 0,3.2 = 0,8 (2) 0,25 - Giải (1) và (2) được: a = 0,1 và b = 0,2 0,25 - Vậy: a + b = 0,3 0,25 Câu 10: Hòa tan hoàn toàn 0,46 gam hỗn hợp A gồm hai kim loại kiềm bằng 200 dung dịch HCl 0,15M (dư), thu được dung dịch B chứa các chất tan có nồng độ mol bằng nhau. Xác định hai kim loại trong hỗn hợp A. - Gọi kí hiệu hóa học của 2 kim loại kiềm là X, Y - PTHH: 2X + 2HCl 2XCl + H2 2Y + 2HCl 2YCl + H2 - Nhận xét: nồng độ mol của các chất tan trong B bằng nhau nên số mol của chúng bằng nhau nXCl = nYCl = nHCl (dư) = a (mol) 0,25 - Có: a + a + a = nHCl ban đầu = 0,03 a = 0,01 0,25 - Có: MX.0,01 + MY.0,01 = 0,46 MX + MY = 46 0,25 X, Y là Li (MLi = 7) và K (MK = 39)
Tài liệu đính kèm:
 de_kiem_tra_1_tiet_lan_3_mon_hoa_hoc_10_chuong_trinh_chuyen.doc
de_kiem_tra_1_tiet_lan_3_mon_hoa_hoc_10_chuong_trinh_chuyen.doc





