Đề kiểm tra 1 tiết chương 5 - Môn: Hóa học 10
Câu 1: Để chứng minh tính oxi hóa thay đổi theo chiều F2>Cl2>Br2>I2, ta dùng phản ứng:
A. halogen tác dụng với H2 B. halogen tác dụng với dung dịch AgNO3
C. halogen tác dụng với kim loại D. halogen tác dụng với H2O
Câu 2: Trong phòng thí nghiệm, người ta thường điều chế khí Cl2 bằng cách
A. điện phân dung dịch NaCl có màng ngăn
B. cho HCl đặc tác dụng với KMnO4, MnO2,.
C. điện phân nóng chảy NaCl
D. phân hủy HCl
Câu 3: Cho phản ứng: Cl2 + H2O ↔ HCl + HClO, vai trò của Cl2 là
A. chất khử B. vừa là chất khử, vừa là chất oxi hóa
C. không là chất khử, không là chất oxi hóa D. chất oxi hóa
Câu 4: Trong các loại acid halogenhidric, acid mạnh nhất là
A. HF B. HCl C. HBr D. HI
Câu 5: Thuốc thử để nhận biết I2 là
A. nước Brom B. phenolphtalein C. quỳ tím D. hồ tinh bột
Câu 6: Cho 3,87g hỗn hợp muối NaX và NaY (X, Y là 2 halogen liên tiếp) tác dụng với dung dịch AgNO3 dư thu được 6,63g kết tủa. X, Y lần lượt là
A. F, Cl B. Cl, Br C. Cl, I D. Br, I
Câu 7: Trong mọi hợp chất, Flo luôn có số oxi hóa là
A. 0 B. +1 C. -1 D. +7
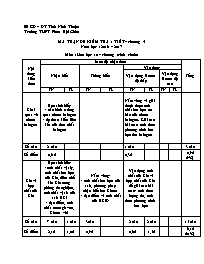
Sở GD – ĐT Tỉnh Ninh Thuận Trường THPT Phan Bội Châu MA TRẬN ĐỀ KIỂM TRA 1 TIẾT – chương 5 Năm học : 2016 – 2017 Môn : Hóa học 10 – chương trình chuẩn Nội dung kiến thức Mức độ nhận thức Tổng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức độ thấp Vận dụng ở mức độ cao TN TL TN TL TN TL TN TL Khái quát về nhóm halogen Học sinh biết: - cấu hình e tổng quát nhóm halogen - dự đoán kiểu liên kết của đơn chất halogen Nắm vững và giải thích được tính chất hóa học cơ bản của nhóm halogen. Giải các bài toán tính theo phương trình hóa học tìm halogen Số câu 2 câu 1 câu 3 câu Số điểm 0,6 đ 0,3đ 0,9đ (9%) Clo và hợp chất của Clo Học sinh biết: - tính chất vật lý, tính chất hóa học của Clo, điều chế khí Clo trong phòng thí nghiệm, tính chất vật lí của axit HCl - đặc điểm, tính chất nước giaven, Clorua vôi Nắm vững: - tính chất hóa học của axit, phương pháp nhận biết ion Clorua - đặc điểm và tính chất của HClO Vận dụng tính chất của Clo và hợp chất của Clo để giải các bài toán: tính theo lượng dư, tính theo phương trình hóa học Số câu 7 câu 1 câu 3câu 2 câu 2 câu 15 câu Số điểm 2,1đ 1,0đ 0,9đ 0,6đ 1,5đ 6,1đ (61%) Flo-brom-iot Học sinh biết: - tính chất vật lý, tính chất hóa học của Flo-Brom-Iot, Nhận biết các ion halogen bằng dung dịch AgNO3 Giải bài toán tính theo pthh tìm các halogen Số câu 4 câu 1 câu 1 câu 6 câu Số điểm 1,2đ 1,5đ 0,3đ 3,0đ (30%) Tổng số câu 13 câu 1 câu 3 câu 1 câu 4 câu 2 câu 24 câu Tổng số điểm 3,9đ (39%) 1,0đ (10%) 0,9đ (9%) 1,5đ (15%) 1,2đ (12%) 1,5đ (15%) 10đ (100%) SỞ GIÁO DỤC & ĐÀO TẠO NINH THUẬN TRƯỜNG THPT PHAN BỘI CHÂU ĐỀ KIỂM TRA 1 TIẾT LẦN 3 Môn: HÓA HỌC 10 – Chuẩn Năm học: 2016-2017 Thời gian làm bài: 45 phút Mã đề thi 132 (Học sinh không được sử dụng tài liệu) Họ và tên học sinh:..................................................................... lớp: ............................. (Cho: Cl = 35,5, Na = 23, O =16, Zn = 65, Mg =24, F = 19, Br = 80, I = 127, Ag = 108, N = 14, H =1) A/ TRẮC NGHIỆM: (6,0đ) Câu 1: Để chứng minh tính oxi hóa thay đổi theo chiều F2>Cl2>Br2>I2, ta dùng phản ứng: A. halogen tác dụng với H2 B. halogen tác dụng với dung dịch AgNO3 C. halogen tác dụng với kim loại D. halogen tác dụng với H2O Câu 2: Trong phòng thí nghiệm, người ta thường điều chế khí Cl2 bằng cách A. điện phân dung dịch NaCl có màng ngăn B. cho HCl đặc tác dụng với KMnO4, MnO2,.. C. điện phân nóng chảy NaCl D. phân hủy HCl Câu 3: Cho phản ứng: Cl2 + H2O ↔ HCl + HClO, vai trò của Cl2 là A. chất khử B. vừa là chất khử, vừa là chất oxi hóa C. không là chất khử, không là chất oxi hóa D. chất oxi hóa Câu 4: Trong các loại acid halogenhidric, acid mạnh nhất là A. HF B. HCl C. HBr D. HI Câu 5: Thuốc thử để nhận biết I2 là A. nước Brom B. phenolphtalein C. quỳ tím D. hồ tinh bột Câu 6: Cho 3,87g hỗn hợp muối NaX và NaY (X, Y là 2 halogen liên tiếp) tác dụng với dung dịch AgNO3 dư thu được 6,63g kết tủa. X, Y lần lượt là A. F, Cl B. Cl, Br C. Cl, I D. Br, I Câu 7: Trong mọi hợp chất, Flo luôn có số oxi hóa là A. 0 B. +1 C. -1 D. +7 Câu 8: Cấu hình electron lớp ngoài cùng của các nguyên tử các nguyên tố halogen là A. ns2np5 B. ns2np6 C. ns2np4 D. ns2np3 Câu 9: Clo là chất.., có màu., rất độc A. rắn, đỏ nâu B. khí, lục nhạt C. lỏng, vàng lục D. khí, vàng lục Câu 10: Khi mở lọ đựng dung dịch HCl đặc trong không khí thấy hiện tượng A. khối lượng lọ đựng axit tăng B. lọ đựng axit nóng lên nhiều C. bốc khói D. dung dịch xuất hiện màu vàng Câu 11: Khi mở vòi nước máy, nếu chú ý một chút sẽ phát hiện mùi lạ. Đó chính là do nước máy còn lưu giữ vết tích của thuốc sát trùng. Đó chính là Clo và người ta giải thích khả năng diệt khuẩn là do A. Clo độc nên có tính sát trùng B. Clo có tính oxi hóa mạnh C. Clo tác dụng với H2O tạo ra HClO, HClO có tính oxi hóa mạnh D. một nguyên nhân khác Câu 12: Liên kết trong các phân tử đơn chất halogen là A. liên kết cộng hóa trị không có cực B. liên kết ion C. liên kết kim loại D. liên kết cộng hóa trị có cực Câu 13: Đặc điểm chung của các đơn chất halogen (F2, Cl2, Br2, I2) là A. có tính oxi hóa mạnh B. tác dụng với H2 ở điều kiện thường C. vừa có tính khử, vừa có tính oxi hóa D. tác dụng với hồ tinh bột Câu 14: Nước giaven là hỗn hợp gồm A. NaCl, HClO, H2O B. NaOH, NaClO, H2O C. NaOH, Cl2, H2O D. NaCl, NaClO, H2O Câu 15: Phản ứng giữa Cl2 và H2 xảy ra ở điều kiện A. ánh sáng B. đun nóng C. bóng tối D. đun nóng, xúc tác Pt Câu 16: Cho sơ đồ phản ứng : MnO2XBr2, X là A. F2 B. Cl2 C. HCl D. HBr Câu 17: Cho 2,24(l) X2 tác dụng vừa đủ với Mg thu được 9,5(g) MgX2. X là A. Iot B. Clo C. Brom D. Flo Câu 18: Muối của một kim loại với nhiều loại gốc axit khác nhau được gọi là A. muối trung hòa B. muối đơn C. muối hỗn tạp D. muối axit Câu 19: Axit có khả năng ăn mòn thủy tinh là A. HCl B. HI C. HF D. HBr Câu 20: Đổ dung dịch chứa 1g HCl vào dung dịch chứa 1g NaOH. Nhúng quỳ tím vào dung dịch thu được, quỳ tím chuyển sang màu A. không đổi màu B. đỏ C. xanh D. mất màu B/ TỰ LUẬN: (4,0đ) Mã đề: 132, 357 ccCâu 1(1,5đ): Có 6 lọ mất nhãn: NaOH, NaF, NaCl, NaBr, NaI, H2SO4. Bằng phương pháp hóa học, hãy nhận biết 6 lọ trên. Viết phương trình hóa học xảy ra (nếu có) ? Câu 2 (2,5đ): Cho 44,5g hỗn hợp gồm bột Zn và Mg tác dụng với dung dịch HCl dư, sau phản ứng tạo ra m(g) muối Clorua và thấy có 22,4(l) khí H2 thoát ra ở (đktc). a/ Viết phương trình hóa học xảy ra? b/ Tính phần trăm khối lượng kim loại có trong hỗn hợp ban đầu? c/ Tính m? Mã đề: 209, 485 Câu 1(1,5đ): Có 6 lọ mất nhãn: KOH, KF, KCl, KBr, KI, HCl. Bằng phương pháp hóa học, hãy nhận biết 6 lọ trên. Viết phương trình hóa học xảy ra (nếu có) ? Câu 2 (2,5đ): Cho 20g hỗn hợp gồm bột Mg và Fe tác dụng với dung dịch HCl dư, sau phản ứng tạo ra m(g) muối Clorua và thấy có 11,2(l) khí H2 thoát ra ở (đktc). a/ Viết phương trình hóa học xảy ra? b/ Tính phần trăm khối lượng kim loại có trong hỗn hợp ban đầu? c/ Tính m? ----------- HẾT ---------- ĐÁP ÁN ĐỀ KIỂM TRA 1 TIẾT Năm học: 2016 – 2017 Môn : Hóa học 10 – chương 5 Mã đề: 132 A/ TRẮC NGHIỆM (6,0đ) : Mỗi câu đúng được 0,3đ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 A B C D B/ TỰ LUẬN (4,0đ): Mã đề: 132, 357 Câu Đáp án Điểm 1 NaOH NaF NaCl NaBr NaI H2SO4 Quỳ tím xanh Không đổi màu Không đổi màu Không đổi màu Không đổi màu Đỏ Dung dịch AgNO3 - ↓ trắng ↓ vàng nhạt ↓ vàng Pt: NaCl + AgNO3 → AgCl↓ + NaNO3 NaBr + AgNO3 → AgBr↓ + NaNO3 NaI + AgNO3 → AgI↓ + NaNO3 1,5đ 0,75đ 0,25đ 0,25đ 0,25đ 2 a/ pt: Zn + 2HCl → ZnCl2 + H2 Mg + 2HCl → MgCl2 + H2 b/ Ta có : nH2 = V/22,4 = 22,4/22,4 = 1 (mol) Gọi x, y lần lượt là số mol của Zn, Mg : Pt: Zn + 2HCl → ZnCl2 + H2 (1) 1 1 1 (mol) x x x (mol) Mg + 2HCl → MgCl2 + H2 (2) 1 1 1 (mol) y y y (mol) Từ (1) và (2), ta có pt: 65x + 24y = 44,5 (3) ; x + y =1 (4) Từ pt (3) và (4), ta được: x = 0,5; y = 0,5 => %mZn = ≈73,03% ; %mMg =≈ 26,97% b/ m = mZnCl2 + mMgCl2 = (0,5.136) + (0,5.95) = 115,5g 2,5đ 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ 0,5đ Mã đề: 209, 485 1 KOH KF KCl KBr KI HCl Quỳ tím xanh Không đổi màu Không đổi màu Không đổi màu Không đổi màu Đỏ Dung dịch AgNO3 - ↓ trắng ↓ vàng nhạt ↓ vàng Pt: KCl + AgNO3 → AgCl↓ + KNO3 KBr + AgNO3 → AgBr↓ + KNO3 KI + AgNO3 → AgI↓ + KNO3 1,5đ 0,75đ 0,25đ 0,25đ 0,25đ 2 a/ pt: Fe + 2HCl → FeCl2 + H2 Mg + 2HCl → MgCl2 + H2 b/ Ta có : nH2 = V/22,4 = 11,2/22,4 = 0,5 (mol) Gọi x, y lần lượt là số mol của Fe, Mg : Pt: Fe + 2HCl → FeCl2 + H2 (1) 1 1 1 (mol) x x x (mol) Mg + 2HCl → MgCl2 + H2 (2) 1 1 1 (mol) y y y (mol) Từ (1) và (2), ta có pt: 56x + 24y = 20 (3) ; x + y =0,5 (4) Từ pt (3) và (4), ta được: x = 0,25; y = 0,25 => %mFe = = 70%; %mMg == 30% b/ m = mFeCl2 + mMgCl2 = (0,25.127) + (0,25.95) = 55,5g 2,5đ 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ 0,5đ
Tài liệu đính kèm:
 de_kiem_tra_1_tiet_chuong_5_mon_hoa_hoc_10.doc
de_kiem_tra_1_tiet_chuong_5_mon_hoa_hoc_10.doc





