Đề kiểm tra 1 tiết (bài số 3) lớp 10 - Môn: Hóa Học (chương trình chuẩn)
Câu 1: Cl (Z = 17). Vị trí của Cl trong bảng tuần hoàn là:
A. CK 2, nhóm VIIA B. CK 3, nhóm VIIB C. CK 3, nhóm VA D. CK 3, nhóm VIIA
Câu 2: Ở điều kiện thường Clo là
A. chất khí, không màu, không độc, tan trong nước B. chất khí, màu lục sáng, độc, không tan trong nước C. chất khí, màu vàng lục, độc, tan trong nước D. chất lỏng, màu nâu đỏ, độc, tan trong nước
Câu 3: Phản ứng nào sau đây không đúng?
A. 2Fe + 6HCl → 2FeCl3 + 3H2 B. 2Fe + 3Cl2 → 2FeCl3
C. HCl + AgNO3 → AgCl + HNO3 C. 2HCl + CaCO3 → CaCl2 + CO2 + H2O
Câu 4: Cho các chất sau: Fe, CuO, Cu, NaOH, AgNO3, Ca(NO3)2, K2CO3, Fe(OH)3. Số chất phản ứng được với axit HCl là A. 8 B. 7 C. 6 D. 5
Câu 5: Hoà tan hoàn toàn 6g kim loại A vào dd HCl. Dung dịch sau phản ứng cô cạn thu được 16,65g muối khan. A là A. Mg B. Ca C. Zn D. Al
Câu 6: Br (Z = 35). Cấu hình eletron của Br là
A. [He]2s22p5 B. [Ne]3s23p5 C. [Ar]3d104s24p5 D. [Ar]4s24p5
Câu 7: Tính oxi hóa của các halogen giảm dần theo chiều dãy nào sau đây?
A. I – Br – Cl – F B. F – Cl – Br – I C. Cl – Br – I – F D. Br – Cl – F – I
Câu 8: Không dùng bình thủy tinh đựng axit nào sau đây?
A. HCl B. HF C. HBr D. HI
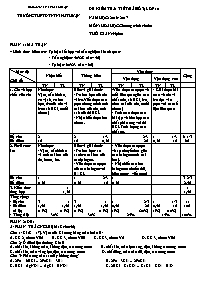
SỞ GDĐT NINH THUẬN TRƯỜNG THPT DTNT NINH THUẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 3) LỚP 10 NĂM HỌC: 2016 - 2017 MÔN: HÓA HỌC Chương trình chuẩn THỜI GIAN: 45 phút PHẦN 1: MA TRẬN * Hình thức kiểm tra: Tự luận kết hợp với trắc nghiệm khách quan: - Trắc nghiệm: 40%(8 câu – 4đ) - Tự luận: 60%(3 câu – 6đ) Mức độ Chủ đề Nhận biết Thông hiểu Vận dụng Cộng Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL 1. Clo và hợp chất của clo Nêu được: Vị trí, cấu hình e, t/c vật lí, t/c hóa học, đ/c của clo và h/c(axit HCl, muối clorua) Hiểu và giải thích: - T/c hóa học của clo và h/c.Viết được các ptpứ chứng minh tính oxi hóa của clo, tính axit của dd HCl. - Nhận biết được ion clorua. -Viết được các ptpứ về mối liên quan giữa các chất (clo, xit HCl, h/c chứa oxi của clo, muối clorua) - Tính toán được các bài tập về hỗn hợp các chất phản ứng với dd HCl. Tính lượng các chất pứ. - Giải được bài toán về clo và h/c dựa vào ptpú với các số liệu liên quan Số câu Số điểm 2 1đ 2 1/3 1đ 0,5đ 2/3 2đ 1 1/3 0,5đ 1đ 6+1/3 6đ 2. Flo-Brom-Iot Nêu được: - Vị trí, cấu hình e và tính oxi hóa của flo, brom, iot. Hiểu và giải thích: - T/c hóa học: so sánh t/c oxi hóa của các halogen. - Viết được các ptpứ của các halogen với H2, KL - Viết được các ptpứ về sự chuyển hóa giữa các halogen (tính oxi hóa). - Nhận biết các ion halogenua(thuốc thử, hiện tượng, viết ptpứ) Số câu Số điểm 1 0,5đ 1 2/3 0,5đ 1đ 1 0,5đ 3+2/3 2,5đ 3. Kiến thức tổng hợp 1 1,5đ 1 1,5đ Tổng cộng: - Số câu - Số điểm (tỉ lệ) - Tổng tỉ lệ 3 1 1,5đ 1,5đ (15%) (15%) 30% 3 1 1,5đ 1,5đ (15%) (15%) 30% 1 2/3 0,5đ 2đ (5%) (20%) 25% 1 1/3 0,5đ 1đ (5%) (10%) 15% 11 10đ 100% PHẦN 2: ĐỀ: A/ PHẦN TRẮC NGHIỆM: 8 câu(4đ) Câu 1: Cl (Z = 17). Vị trí của Cl trong bảng tuần hoàn là: A. CK 2, nhóm VIIA B. CK 3, nhóm VIIB C. CK 3, nhóm VA D. CK 3, nhóm VIIA Câu 2: Ở điều kiện thường Clo là A. chất khí, không màu, không độc, tan trong nước B. chất khí, màu lục sáng, độc, không tan trong nước C. chất khí, màu vàng lục, độc, tan trong nước D. chất lỏng, màu nâu đỏ, độc, tan trong nước Câu 3: Phản ứng nào sau đây không đúng? A. 2Fe + 6HCl → 2FeCl3 + 3H2 B. 2Fe + 3Cl2 → 2FeCl3 C. HCl + AgNO3 → AgCl + HNO3 C. 2HCl + CaCO3 → CaCl2 + CO2 + H2O Câu 4: Cho các chất sau: Fe, CuO, Cu, NaOH, AgNO3, Ca(NO3)2, K2CO3, Fe(OH)3. Số chất phản ứng được với axit HCl là A. 8 B. 7 C. 6 D. 5 Câu 5: Hoà tan hoàn toàn 6g kim loại A vào dd HCl. Dung dịch sau phản ứng cô cạn thu được 16,65g muối khan. A là A. Mg B. Ca C. Zn D. Al Câu 6: Br (Z = 35). Cấu hình eletron của Br là A. [He]2s22p5 B. [Ne]3s23p5 C. [Ar]3d104s24p5 D. [Ar]4s24p5 Câu 7: Tính oxi hóa của các halogen giảm dần theo chiều dãy nào sau đây? A. I – Br – Cl – F B. F – Cl – Br – I C. Cl – Br – I – F D. Br – Cl – F – I Câu 8: Không dùng bình thủy tinh đựng axit nào sau đây? A. HCl B. HF C. HBr D. HI B/ PHẦN TỰ LUẬN: Câu 1(1,5đ): Viết các phương trình phản ứng hoàn thành chuỗi sau: HCl Cl2 NaCl Cl2 Br2 I2 FeI2 Câu 2: (1,5đ): Trong phòng thí nghiêm có 4 lọ không nhãn đựng các dung dịch: HCl, NaCl, NaBr, NaNO3. Bằng phương pháp hóa học hãy nhận biết mỗi dung dịch đựng trong các lọ đó. Câu 3: Cho 20g hỗn hợp gồm Fe và Cu vào dd HCl lấy dư 20% so với lượng phản ứng thì thu được 6,72 lít khí H2 (đktc) và dd X. a) Tính thành phần phần trăm mỗi kim loại có trong hỗn hợp và xác định thành phần hóa học các chất có trong dd X? b) Tính thể tích dd AgNO3 2M đủ để kết tủa hết dd X? (Biết: Fe=56; Ag=108; N=14; O=16) SỞ GDĐT NINH THUẬN TRƯỜNG THPT DTNT NINH THUẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 3) LỚP 10 NĂM HỌC: 2016 - 2017 MÔN: HÓA HỌC Chương trình chuẩn THỜI GIAN: 45 phút ĐÁP ÁN , HƯỚNG DẪN CHẤM, TRẮC NGHIỆM, TỰ LUẬN A/ PHẦN TRẮC NGHIỆM: 8 câu(4đ) CÂU ĐÁP ÁN ĐIỂM 1 D 0.5 2 C 0.5 3 A 0.5 4 C 0.5 5 B 0.5 6 C 0.5 7 B 0.5 8 B 0.5 B/ PHẦN TỰ LUẬN: 3 câu(6đ) Câu ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM Biểu điểm Câu 1 Viết đúng mỗi phương trình phản ứng (có đk và cân bằng nếu có) được 0,25đ (1) 4HClđ + MnO2 → MnCl2 + Cl2 + 2H2O (2) Cl2 + 2Na 2NaCl (3) 2NaCl + 2H2O Cl2 + H2 2NaOH (4) Cl2+ 2NaBr → 2NaCl + Br2 (5) Br2 + 2NaI → 2NaBr + I2 (6) Fe + I2 FeI2 1,5đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ Câu 2 Lần lượt nhúng quỳ tím vào 4 mẫu thử, mẫu thử làm quỳ tím hóa đỏ là HCl, 3 mẫu còn lại là dd NaCl, NaBr, NaNO3. Lần lượt nhỏ dd AgNO3 vào mẫu thử 3dd còn lại, mẫu thử sau phản ứng tạo kết tủa trắng là dd NaCl: ptpứ: NaCl + AgNO3 → AgCl↓ + NaNO3 Mẫu thử sau phản ứng tạo kết tủa vàng nhạt là NaBr: ptpứ: NaBr + AgNO3 → AgBr↓ + NaNO3 Mẫu thử không có hiện tượng là NaNO3 1,5đ 0,25đ 0,5đ 0,5đ 0,25đ Câu 3 a) nH2 = = 0,3 (mol) Ptpứ: Fe + 2HCl → FeCl2 + H2↑ (mol) 0,3 0,6 0,3 0,3 %mFe = = 84% %mCu = 100% - 84% = 16% Dung dịch X gồm: FeCl2 (0,3 mol) và HCl (dư: 0,6. 0,2 = 0,12 mol) b) Ptpứ: FeCl2 + 2AgNO3 → 2AgCl↓ + Fe(NO3)2 (mol) 0,3 0,6 HCl + AgNO3 → AgCl↓ + HNO3 (mol) 0,12 0,12 VddHCl = = 0,36(lit) 3đ (2đ) 0,25đ 0,5đ 0,5đ 0,25đ 0,5đ (1đ) 0,25đ 0,25đ 0,5đ Lưu ý: Học sinh có thể giải bằng cách khác nếu đúng vẫn được điểm tối đa
Tài liệu đính kèm:
 de_kiem_tra_1_tiet_bai_so_3_lop_10_mon_hoa_hoc_chuong_trinh.doc
de_kiem_tra_1_tiet_bai_so_3_lop_10_mon_hoa_hoc_chuong_trinh.doc





