Bài kiểm tra kì II (bài số 6) môn: Hóa Học 10
Câu 1 : Cho các axit: H2SO3, H2SO4, H2S. Dãy sắp xếp theo thứ tự tính axit tăng dần là:
A. H2SO3 < h2so4="">< h2s="" b.="">< h2s=""><>
C. H2S < h2so4="">< h2so3="" d.="" h2s="">< h2so3=""><>
Câu 2 : Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, Flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu và có khả năng ăn mòn thủy tinh.
(c) Dung dịch NaF tác dụng được với dd AgNO3.
(d) Để nhận biết dung dịch Iot, thuốc thử là hồ tinh bột.
Trong các phát biểu trên, số phát biểu đúng là
A. 3 B. 4 C. 2 D. 1
Câu 3 : Rót dung dịch AgNO3 vào 4 lọ dd riêng biệt: NaF, NaCl, NaBr, NaI. Có mấy lọ tạo kết tủa?
A. 2 B. 3 C. 4 D. 1
Câu 4 : Cho 6g kẽm hạt vào một cốc đựng dd H2SO4 4M (dư) ở nhiệt độ thường. Nếu giữ nguyên các điều kiện khác, chỉ biến đổi một trong các điều kiện sau đây thì ở trường hợp nào có tốc độ phản ứng không đổi?
A. Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 500C) B. Dùng thể tích dd H2SO4 4M gấp đôi ban đầu
C. Thay dd H2SO4 4M bằng dd H2SO4 2M D. Thay 6g kẽm hạt bằng 6g kẽm bột
Câu 5 : Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống là lợi dụng yếu tố nào sau đây để tăng tốc độ của phản ứng:
A. Diện tích bề mặt chất phản ứng. B. Nhiệt độ. C. Áp suất. D. Nồng độ.
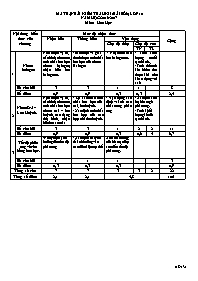
MA TRẬN BÀI KIỂM TRA HK II (BÀI SỐ 6) LỚP 10
NĂM HỌC: 2016-2017
Môn: Hóa Học
Nội dung kiến thức của chương
Mức độ nhận thức
Cộng
Nhận biết
Thông hiểu
Vận dụng
Cấp độ thấp
Cấp độ cao
TN
TL
1
Nhóm halogen
Nêu được vị trí, cấu hình electron, tính chất hóa học nhóm halogen, nhận biết ion halogenua.
- Minh họa và giải thích được tính chất hóa học của nhóm Halogen
- Nhận biết các ion halogenua.
- Tính khối lượng muối tạo thành.
- Tính thể tích khí hidro thu được khi cho kl tác dụng với axit
Số câu hỏi
3
3
1
1
8
Số điểm
0,9
0,9
0,3
0,3
2,4
2
Nhóm Oxi – Lưu Huỳnh.
Nêu được vị trí, cấu hình electron, tính chất hóa học nhóm oxi – lưu huỳnh, các dạng thù hình, nhận biết ion sunfat
- So sánh các tính chất hóa học của oxi, lưu huỳnh.
- Xác định tính chất hóa học của các hợp chất lưu huỳnh.
- Vận dụng xác định vai trò các chất trong phản ứng
- Xác định kim loại tham gia phản ứng.
- Tính khối lượng kết tủa tạo thành.
Số câu hỏi
3
3
1
2
2
11
Số điểm
0,9
0,9
0,3
0,6
4
6,7
3
Tốc độ phản ứng và cân bằng hoá học.
-Nêu yếu tố ảnh hưởng đến tốc độ phản ứng
- Xác định các yếu tố ảnh hưởng vào các điều kiện cụ thể
Xét ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng.
Số câu hỏi
1
1
1
3
Số điểm
0,3
0,3
0,3
0,9
Tổng số câu
7
7
3
3
2
22
Tổng số điểm
2,1
2,1
5,8
10đ
SỞ GD-ĐT NINH THUẬN ĐỀ KIỂM TRA HỌC KỲ II (BÀI SỐ 6) - LỚP 10
TRƯỜNG THPT BÁC ÁI NĂM HỌC 2016-2017
Môn: Hóa học – Chương trình chuẩn
Mã đề: 131
Thời gian làm bài: 45 phút
(Không kể thời gian phát đề)
Đề ra: (Đề kiểm tra có 02 trang)
PHẦN TRẮC NGHIỆM (6đ)
Câu 1 :
Cho các axit: H2SO3, H2SO4, H2S. Dãy sắp xếp theo thứ tự tính axit tăng dần là:
A.
H2SO3 < H2SO4 < H2S
B.
H2SO3< H2S < H2SO4
C.
H2S < H2SO4 < H2SO3
D.
H2S < H2SO3 < H2SO4
Câu 2 :
Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, Flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu và có khả năng ăn mòn thủy tinh.
(c) Dung dịch NaF tác dụng được với dd AgNO3.
(d) Để nhận biết dung dịch Iot, thuốc thử là hồ tinh bột.
Trong các phát biểu trên, số phát biểu đúng là
A.
3
B.
4
C.
2
D.
1
Câu 3 :
Rót dung dịch AgNO3 vào 4 lọ dd riêng biệt: NaF, NaCl, NaBr, NaI. Có mấy lọ tạo kết tủa?
A.
2
B.
3
C.
4
D.
1
Câu 4 :
Cho 6g kẽm hạt vào một cốc đựng dd H2SO4 4M (dư) ở nhiệt độ thường. Nếu giữ nguyên các điều kiện khác, chỉ biến đổi một trong các điều kiện sau đây thì ở trường hợp nào có tốc độ phản ứng không đổi?
A.
Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 500C)
B.
Dùng thể tích dd H2SO4 4M gấp đôi ban đầu
C.
Thay dd H2SO4 4M bằng dd H2SO4 2M
D.
Thay 6g kẽm hạt bằng 6g kẽm bột
Câu 5 :
Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống là lợi dụng yếu tố nào sau đây để tăng tốc độ của phản ứng:
A.
Diện tích bề mặt chất phản ứng.
B.
Nhiệt độ.
C.
Áp suất.
D.
Nồng độ.
Câu 6 :
Tốc độ phản ứng phụ thuộc vào các yếu tố nào sau đây:
A.
Chất xúc tác, diện tích bề mặt.
B.
Nồng độ, áp suất.
C.
Nhiệt độ.
D.
Tất cả các yếu tố.
Câu 7 :
Nhận xét nào về Lưu huỳnh là không đúng?
A.
Lưu huỳnh có tính oxi hóa yếu hơn oxi
B.
Lưu huỳnh tà phương và lưu huỳnh đơn tà là 2 dạng thù hình của nguyên tố lưu huỳnh
C.
Lưu huỳnh chỉ có số oxi hóa -2 trong mọi hợp chất
D.
Lưu huỳnh thể hiện tính oxi hóa và tính khử
Câu 8 :
Đơn chất halogen có tính oxi hoá mạnh nhất là
A.
F2
B.
Cl2
C.
I2
D.
Br2
Câu 9 :
Cho 11,2g kim loại có hóa trị II tác dụng hết với dd H2SO4 loãng, dư thu được 4,48 lit khí H2 (đkc). Kim loại đó là
A.
Al
B.
Cu
C.
Zn
D.
Fe
Câu 10 :
Cho lượng dư dung dịch AgNO3 tác dụng với dung dịch chứa 0,1 mol NaCl. Khối lượng kết tủa tạo thành là
A.
28,7 g
B.
14,35 g
C.
10,8 g
D.
21,6 g
Câu 11 :
Cấu hình electron khái quát của nhóm Halogen là
A.
ns2 np5
B.
ns2 np3
C.
ns2 np6
D.
ns2 np4
Câu 12 :
SO2 và SO3 đều thuộc loại oxit
A.
lưỡng tính
B.
bazơ
C.
trung tính
D.
axit
Câu 13 :
Cấu hình e khái quát của nhóm Oxi – lưu huỳnh là
A.
ns2 np5
B.
ns2 np6
C.
ns2 np4
D.
ns2 np3
Câu 14 :
Dung dịch làm giấy quỳ tím chuyển sang màu đỏ là
A.
HCl
B.
H2S
C.
NaOH
D.
NaCl
Câu 15 :
Dãy gồm các kim loại đều phản ứng với dd HCl là:
A.
Ag, Mg, Al
B.
Cu, Hg, Au
C.
Zn, Al, Fe
D.
Mg, Fe, Cu
Câu 16 :
Đơn chất I2 hầu như không tác dụng được với
A.
H2O
B.
nhôm
C.
khí H2
D.
hồ tinh bột
Câu 17 :
Cho các hợp chất: H2S (1), H2SO3 (2), SO3 (3). Thứ tự các chất trong đó số oxi hóa của S tăng dần là:
A.
(1), (3), (2)
B.
(2), (1), (3)
C.
(3), (1), (2)
D.
(1), (2), (3)
Câu 18 :
Cho lượng dư dung dịch BaCl2 tác dụng với dung dịch chứa 21,3g Na2SO4. Cô cạn dung dịch sau phản ứng, thu được m (g) kết tủa trắng. Giá trị m là
A.
69,9
B.
23,3
C.
17,55
D.
34,95
Câu 19 :
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
A.
Al
B.
Mg
C.
Ag
D.
Na
Câu 20 :
Cho phản ứng: 2SO2 + O2 → 2SO3
Vai trò của các chất trong phản ứng là:
A.
SO2 vừa là chất khử vừa là chất oxi hóa
B.
SO2 là chất oxi hóa
C.
SO2 là chất khử, O2 là chất oxi hóa
D.
SO2 là chất oxi hóa, O2 là chất khử
PHẦN TỰ LUẬN (4đ)
Câu 1: (2 điểm)
Viết các phương trình phản ứng xảy ra cho sơ đồ chuyển hóa sau:
Câu 2: (2 điểm)
Hoà tan hoàn toàn 14,8g hỗn hợp gồm Fe và Cu trong lượng dư dd H2SO4 loãng. Sau khi phản ứng kết thúc thì thu được 3,36 lít khí H2(đktc). Tính khối lượng của Fe và Cu trong hỗn hợp đầu.
(Cho biết khối lượng nguyên tử của: Ag=108; Cl=35,5; Ba=137; S=32; Na=23; O=16; Cu=64; Al=27; Fe=56; Zn=65)
--- Hết ---
SỞ GD – ĐT NINH THUẬN
TRƯỜNG THPT BÁC ÁI
Đề chính thức
ĐỀ KIỂM TRA HỌC KỲ II (BÀI SỐ 6) – LỚP 10
NĂM HỌC 2016 – 2017
Môn: Hóa học – Chương trình chuẩn
ĐÁP ÁN ĐỀ 131
A/ TRẮC NGHIỆM (6 điểm)
Câu
1
2
3
4
5
6
7
8
9
10
Đ/án
D
A
B
B
B
D
C
A
D
B
Câu
11
12
13
14
15
16
17
18
19
20
Đ/án
A
D
C
A
C
A
D
D
C
C
B/ TỰ LUẬN ( 4 điểm)
CÂU
ĐÁP ÁN
ĐIỂM
1
0,4
0,4
0,4
0,4
0,4
2
số mol H2=0,15
viết ptpư
số mol Fe = 0,15
khối lượng Fe= 8,4g
khối lượng Cu= 6,4g
0,25
0,5
0,25
0,5
0,5
phiÕu soi - ®¸p ¸n (Dµnh cho gi¸m kh¶o)
M«n : HK II - K10
M· ®Ò : 111
01
{ | } )
02
) | } ~
03
{ ) } ~
04
{ ) } ~
05
{ ) } ~
06
{ ~ } )
07
{ | ) ~
08
) | } ~
09
{ | } )
10
{ ) } ~
11
) | } ~
12
{ | } )
13
{ | ) ~
14
) | } ~
15
{ | ) ~
16
) | } ~
17
{ | } )
18
{ | } )
19
{ | ) ~
20
{ | ) ~
Tài liệu đính kèm:
 bai_kiem_tra_ki_ii_bai_so_6_mon_hoa_hoc_10.doc
bai_kiem_tra_ki_ii_bai_so_6_mon_hoa_hoc_10.doc





